介紹
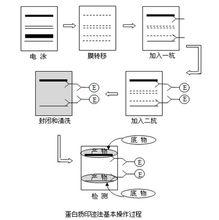 Westernblot法
Westernblot法是美國史丹福大學的喬治·斯塔克發明的,Western Blot法的名字就由發明者Southern與印跡的對象DNA相結合得出的Southern blot。後來又出現了兩個過程相似但對象不同的印跡方法,一個針對RNA,一個針對蛋白質,這兩種技術分別被稱為Northern和Western,Western Blot法的叫法最終被確定下來。
W前世
 Westernblot法
Westernblot法生物大分子印跡法實際上是凝膠電泳技術、固定化技術及分子親和技術三者融為一體的綜合性技術,其核心在於把凝膠電泳已分離的區帶轉移並印跡於固定化紙上。
生物大分子印跡法始創於1975年,內蘇格蘭愛丁堡大學E.M.Southern首先提出。他將限制酶切後的DNA片段先進行瓊脂糖凝膠電泳,把一張硝酸纖維素紙放在凝膠上,利用毛細作用原位凝膠中的DNA八片段轉移到硝酸纖維素紙上使之固定化。由於這種技術類似用吸乾作品上的墨跡,使吸墨紙染上墨跡而被稱為印跡法(blotting)。
1979年,Towbin等人利用電洗脫裝置作為印跡動力,首先把Westernblot法用於抗原撿出,並稱之為免疫印跡法(immunoblotting)。對應於Southern(DNA分子雜交)、Northern(RNA分子雜交)。
1981年Burnette把免疫印跡法稱為Western blotting即蛋白質印跡法-Westernblot法。
套用
Westernblot法套用分子生物學、生物化學和免疫遺傳學中時常會用到的一種實驗方法,並且是一種能對蛋白進行定性和半定量的分析方法。是通過特異性抗體對凝膠電泳處理過的細胞或生物組織樣品進行著色,並且通過分析著色的位置和著色深度獲得特定蛋白質在所分析的細胞或組織中的表達情況的信息。
蛋白質分析中套用的W estern雜交法與DNA分析套用的Southern雜交法相似,均是把電流分離的組分從凝膠轉移至一種固相支持體,並均以針對特定胺基酸(Westernblot法)或核苷酸(Southern雜交法)序列所製備的特異性樣品作為探針檢測其相同或相似序列。
對於蛋白質來說,通常使用的探針是抗體,它與附著於固相支持體的靶蛋白所呈現的抗原表位發生特異性反應。Westernblot法的主要優點在於,它能夠從生物組織的粗提物或部分純化的粗提物中檢測和識別幾種特異的蛋白質。將聚丙烯醯胺凝膠電泳(SDS—PAGE)分離的蛋白質從聚丙烯醯胺凝膠上通過電轉移到一張合適的印跡膜上,隨後用和靈敏檢測系統相偶聯的抗體來識別結合在膜上的一種或幾種蛋白質。這一技術的靈敏度能達到標準的固相放射免疫分析的水平而又無需像免疫沉澱法那樣必須對靶蛋白進行放射性標記。因此要對非放射性標記蛋白組成的複雜混合物中的某些特定蛋白進行鑑別和定量時,Westernblot法極為有用。此外,由於蛋白質的電泳分離幾乎總在變性條件下進行,因此溶解、聚集以及靶蛋白與外來蛋白的共沉澱等諸多問題全都無需加以考慮。
儀器
伯樂生命bio-rad-Trans-Blot 轉印槽是一種多功能儀器,適用於多種Westernblot法套用。
功能和優點:能進行多膠轉印
多組參數靈活可設,可調節的電壓設定(從30V的過夜轉印到到 200 V的1 小時快速實驗)。
電極間距設定為8cm可用於標準轉印,設定為4cm用於高強度轉印。
採用特級冷卻芯和水循環冷卻裝置來調節溫度-是天然酶(4°C)或高強度轉印的理想選擇,隨著轉印時間增加(多達24小時),不會引起緩衝液耗竭。
帶鉸鏈的凝膠制膠轉印夾能避免滑動,確保凝膠和印跡膜的緊密接觸。
每個轉印夾都有顏色標記以保證在轉印槽的正確定位。
套用和用途:Western 雜交,核酸轉印。

