操作流程
 Realtime PCR
Realtime PCR1 收集樣品
2 相關試劑 總RNA提取試劑TREzol Reagent (RNA提取試劑), M-MLV(cDNA逆轉錄酶), RNA 純化試劑, RealqPCR MasterMix (螢光定量PCR預混試劑)。
3 實驗儀器 螢光定量PCR儀; PCR儀;低溫離心機。
4 總RNA提取
5 cDNA合成 在0.5ml的離心管中加入1µl模板總RNA(1µg/µl); 2µl隨機引物(T18, 10pmol/ul);2µl 10mM dNTP mix;加水至15µl體系。混勻後70℃變性RNA 5分鐘,冰上速冷1分鐘,離心將溶液收集至管底加入6µl 5×PCR buffer;1µl RNaseout;1µl M-MLV RT;加水至30µl體系。PCR儀中反應條件設定 37℃延伸60min,70℃保溫15min終止反應。合成好的cDNA置於 -20 ℃保存備用。
 thermal cycler protocol
thermal cycler protocol6 引物設計與合成
引物需要管家基因引物與目標基因引物。
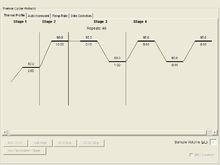
7 實時定量PCR 按以下反應體系進行: 2x RealqPCR MasterMix(Modified DNA polymerase、SYBR Green I、Optimized PCR buffer、5mM MgCI2、dNTP mix including dUTP)25ul;上游引物F 1 ul,下游引物R 1 ul;cDNA template 2ul。定量PCR儀擴增反應條件設定:50 ℃ 2min ;95 ℃ 10min ;95℃ 15s --60 ℃ 60 s (40個循環)。
8 PCR產物溶解曲線分析 將所擴增的PCR 產物進行溶解曲線分析,單峰溶解曲線表示擴增產物單一,無非特異性擴增產物。溶解曲線生成的反應程式為: 95 ℃ 15s , 60 ℃ 15 s , 95 ℃ 15s。
9 數據分析軟體對數據進行處理分析。
主要套用
1. DNA 或RNA 的絕對定量分析:包括病原微生物或病毒含量的檢測,轉基因動植物轉基因拷貝數的檢測,RNAi 基因失活率的檢測等;
2. 基因表達差異分析:例如比較經過不同處理樣本之間特定基因的表達差異(如藥物處理、物理處理、化學處理等 ),特定基因在不同時相的表達差異以及cDNA 晶片或差顯結果的確證;
3. 基因分型:例如SNP 檢測,甲基化檢測等。
常用方法
Realtime PCR 常用的兩種方法分別為Sybr green(螢光染料摻入法)和Taqman probe (探針法)。
螢光染料摻入法:
在PCR反應體系中,加入過量SYBR螢光染料,SYBR螢光染料特異性地摻入DNA雙鏈後,發射螢光信號,而不摻入鏈中的SYBR染料分子不會發射任何螢光信號,從而保證螢光信號的增加與PCR產物的增加完全同步。
此方法適用於:
1、靈敏度高:使用SYBR可使螢光效果增強到1000倍以上
2、通用性好,不需要設計探針,方法簡便,省時,價格低廉。
3、通用型方法,在國內外科研中普遍使用。
4、高通量大規模的定量PCR檢測
5、專一性要求不高的定量PCR檢測。
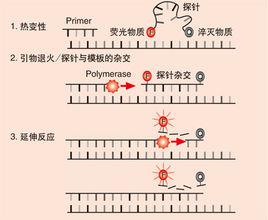
探針法:
PCR擴增時在加入一對引物的同時加入一個特異性的螢光探針,該探針為一寡核苷酸,兩端分別標記一個報告螢光基團和一個淬滅螢光基團。探針完整時,報告基團發射的螢光信號被淬滅基團吸收;PCR擴增時,Taq酶的5’-3’外切酶活性將探針酶切降解,使報告螢光基團和淬滅螢光基團分離,從而螢光監測系統可接收到螢光信號,即每擴增一條DNA鏈,就有一個螢光分子形成,實現了螢光信號的累積與PCR產物形成完全同步
此方法適用於:
1、具有高適應性和可靠性,實驗結果穩定重複性好,特異性更高。
2、適用於擴增序列專一的體系的檢測。
3、樣品中靶基因含量過低的定量PCR檢測。
4、靶基因的特異序列較短,無論怎樣最佳化引物設計條件都不能解決。
5、存在與靶基因同源的序列,在PCR中容易出現非特異性擴增,對特異性要求較高的定量。
6、廣泛用於人類傳染病的診斷和病原定量,在動物病原體基因的檢測,畜禽產品的檢驗檢疫,生物製品的鑑定。