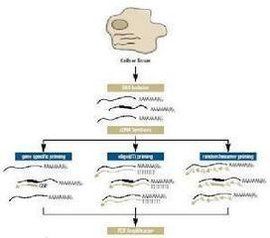
RT-PCR簡介
首先經反轉錄酶的作用從RNA合成 cDNA,再以cDNA為模板,擴增合成目的片段。RT-PCR技術靈敏而且用途廣泛,可用於檢測細胞中基因表達水平,細胞中RNA病毒的含量和直接克隆 特定基因的cDNA序列。作為模板的RNA可以是總RNA、mRNA或體外轉錄的RNA產物。無論使用何種RNA,關鍵是確保RNA中無RNA酶和基因組 DNA的污染。
提取組織或細胞中的總RNA,以其中的mRNA作為模板,採用Oligo(dT)或隨機引物利用反轉錄酶反轉錄成cDNA。再以cDNA為模板經行PCR擴增,而獲得目的基因或檢測基因表達。
過程
RT-PCR可以用一步法或兩步法的形式進行。在兩步法RT-PCR中,每一步都在最佳條件下進行。cDNA的合成首先在反轉錄緩衝液中進行,然後取出1/10的反應產物進行PCR。在一步法RT-PCR中,在同時為反轉錄和PCR最佳化的條件下,反轉錄和PCR順次進行。
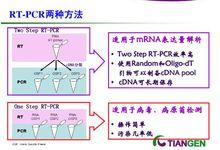 兩種方法
兩種方法1、反轉錄酶的選擇1、Money 鼠白血病病毒反轉錄酶
有較強的聚合酶活性,RNA酶H活性相對較弱。最適作用溫度為37°。
2、AMV反轉錄酶
有強的聚合酶活性和RNA酶H活性。最適溫度為42°。
2、合成cDNA引物的選擇
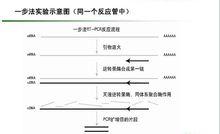 一步法
一步法用於反轉錄的引物可視實驗的具體情況選擇隨機引物、Oligo dT 及基因特異性引物中的一種。對於短的不具有發卡結構的真核細胞mRNA,三種都可。RT-PCR引物的選擇:
1. 隨機引物 適用於長的或具有發卡結構的RNA。適用於rRNA、mRNA、tRNA 等所有RNA的反轉錄反應。主要用於單一模板的RT-PCR反應。
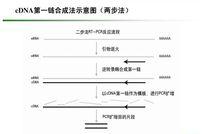 兩步法
兩步法2. Oligo dT 適用於具有PolyA尾巴的RNA。(原核生物的RNA、真核生物的rRNA和tRNA不具有PolyA尾巴。)由於Oligo dT要結合到PolyA 尾巴上,所以對RNA樣品的質量要求較高,即使有少量降解也 會使全長cDNA合成量大大減少。
3. 基因特異性引物 與模板序列互補的引物,適用於目的序列已知的情況。
影響因素
RT-PCR反應受多個因素影響,如硫酸鎂的濃度, 引物退火的溫度,擴增的循環數等。
1、建議選擇0.5-3.0 mM (相差0.5 mM)的硫酸鎂作初步實驗。
2、對於具有較高Tm的引物,增加退火和延伸時的溫度對反應有利。較高的溫度有利於減少非特異的引物結合,因而提高特異產物的得率。
3、大多數目標RNA經40輪PCR反應就能觀察到。但如果目標RNA太稀少,或者只有很少的起始材料,有必要增加擴增的次數到45-50次。