簡介
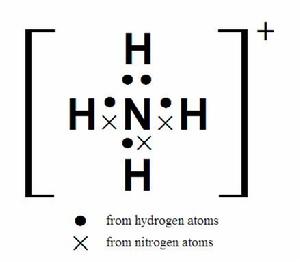 銨根離子的電子式
銨根離子的電子式由氨衍生氨合質子NH₄ 。也叫“銨根”,它是化 學中的一種陽性復根,用NH₄ 表示。它和一價金屬離子相似。它的鹽類稱為銨鹽。如化肥硫銨和碳酸銨的分子都含有銨。
銨離子的性質和鉀離子相近,在溶液中呈+1價。銨鹽都呈白色晶體,加鹼研磨(相當於加熱)能生成有刺激性氣味的氨氣(化學式:NH₃),銨鹽受熱會分解。
還原性
銨根離子有較強的還原性(熱力學上),但受動力學因素阻礙,酸性溶液中銨的還原性很多時候難以體現 :
例如,強氧化性的氯氣和溴都不會氧化銨:
Br+2NHCl→NHClBr
3Cl+NH —(pH<4.4)→3Cl +NCl+4H
(pH>8.5生成NHCl,pH=4.5-5生成NHCl)
(氯胺,二氯胺,三氯化氮中氯氧化數均為+1)
但也可以在一些反應中或固態物質中體現 :
與亞硝酸根反應:
NO +NH →N↑+2HO
硝酸銨爆炸:
NHNO—(190℃—200℃慢慢加熱)→NO↑+2HO
2NHNO—(低溫慢慢加熱)→N↑+2NO+2HO
5NHNO—(190℃)→2N↑+4HNO+9HO
與氧氣反應:
4O+NH —(硝化細菌)→NO +HO+2H
重鉻酸銨分解:
(NH)CrO—(加熱)→CrO+N↑+4HO
高錳酸銨在水中分解:
2MnO +2NH =2MnO+N↑+4HO
結構
銨離子是正四面體型的,與甲烷互為等電子體。
用途
用於銨鹽中含氮,鹽可用作氮肥,稱為銨態氮肥。此類肥料不宜與鹼性肥料混用,否則銨離子會被反應掉從而肥效降低。
常見的銨態氮肥有:硫銨、碳銨、硝銨。
檢驗方法
銨鹽的檢驗方法通常是與鹼混合(必要時加熱),會放出氨氣。例如:
NHHCO+Ca(OH)→CaCO+2HO+NH↑
(NH)SO+2NaOH→NaSO+2HO+2NH↑
原理是銨鹽與鹼發生複分解反應,生成新鹽和一水合氨,一水合氨易揮發為氨氣和水。
NH +OH =(加熱)→NH↑+HO
銨鹽可以與奈斯勒試劑反應生成黃棕色沉澱,用於定性檢驗 。
NH + 2[HgI] + 4OH → HgO·Hg(NH)I + 7I + 3HO
衍生物
銨離子的氫原子可以被其他其他原子或原子團取代形成一個取代銨離子。根據其他其他原子或原子團的數目,銨陽離子被稱為一級、二級、三級或四級。
除季銨陽離子外,有機銨陽離子均為弱酸。
一個形成銨離子的例子:(CH)NH和酸形成陽離子:(CH)NH :
(CH)NH+H →(CH)NH
![NH4+[氨分子衍生出的陽離子] NH4+[氨分子衍生出的陽離子]](/img/6/1e6/nBnauM3XyAzNyEDMxEDOwgDM1UTM1QDN5MjM5ADMwAjMwUzLxgzL3EzLt92YucmbvRWdo5Cd0FmLyE2LvoDc0RHa.jpg)
