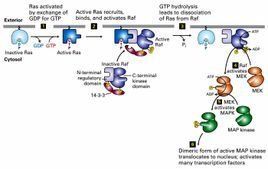
MAPK信號通路成員
MAPK是信號從細胞表面傳導到細胞核內部的重要傳遞者。已在哺乳動物細胞中鑑定了14種MKKK,7種MKK和12種MAPK。分析顯示,這些激酶屬於不同亞族。
MKKK
MKKK的4個亞族已得到鑑定,其中Raf亞族研究的最為透徹,包括B-Raf、A-Raf、Raf1。MEKK亞族由4種MEKK(MEKK1~MEKK4)構成。ASK1和Tpl2組成了MKKK的第三個亞族。第四個亞族與上述三個有較大不同,它包括MST(mammalian sterile 20-like)、SPRK、MUK(MAPK upstream kinase)、TAK1,以及相關程度最小的MOS(molony sarcoma oncoprotein)。
MKK
對於MKK來說,MEK1與MEK2密切相關,而MKK3則與MKK6密切相關。
MAPK
MAPK可分為4個亞族:ERK、p38、JNK和ERK5。這些通路由它們而得名,例如利用JNK的MAPK通路被稱為JNK通路。
MAPK結構
一級結構
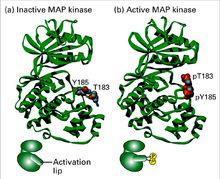 MAPK雙磷酸化
MAPK雙磷酸化MKK都是通過雙位點,即蘇氨酸(T)和酪氨酸(Y)同時磷酸化激活MAPK。這兩個磷酸化位點中間被一胺基酸隔開,構成三肽基TXY。不同的MAPK亞族成員,其雙磷酸化位點之間的X殘基不同,但是其各個亞族都具有標準的12個保守亞區,這些亞區是區分真核細胞蛋白激酶超家族的標誌之一。MAPK家族成員之間具有較高的同源性。例如,p38β、p38γ和p38δ分別與p38α具有75%、62%和64%的同源性,而與其他MAPK家族成員的同源性約為40%~50%。三肽基位於蛋白激酶地VII和VIII亞區之間的Loop12環狀結構內,該環位於分子表面並臨近活性位點,其中部分殘基形成一種唇狀結構,被稱為磷酸化唇或活化唇(activation lip)。這一區域被認為是決定包括MAPK在內的多種蛋白激酶活性的關鍵結構。
二級和超二級結構
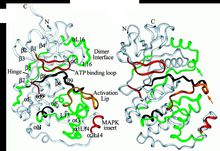 ATP結合位點示意圖
ATP結合位點示意圖與其他蛋白激酶相似,ERK2、p38和JNK1都具有一個較小的胺基酸結構域和一個較大的羧基端結構域,兩者
之間由一個交叉區連線在一起。胺基酸結構域主要由β摺疊組成,而羧基端結構域則主要為α螺鏇,兩個結構與交界處形成一個裂隙,為ATP結合位點。
空間結構
大體結構:
p38與ERK2具有約40%序列同源性。將p38和ERK2的兩個結構域同時重疊在一起時,其根均平方(root mean square ,RMS)偏離為0.17nm。JNK與ERK2和p38的同源性分別為40%和51%,其總體結構也與ERK2和p38非常相似。將ERK2和p38的羧基端結構域與JNK的羧基端結構域重疊式,兩者較JNK3的羧基端結構域分別鏇轉了2.5°和4°。將ERK2的胺基酸和羧基端結構域與JNK3的對應結構域重疊時,其RMS偏離分別為0.115nm和0.158nm。
底物結合口袋的結構特徵:
在所有MAPK中,形成底物結合口袋的胺基酸殘基都是相當保守的。在未受到刺激時,ERK2的底物結合口袋被Arg占據;當ERK2被磷酸化後,Arg轉離原來的位置,從而暴露出底物結合口袋來進行底物的結合。p38中,該位點活化機制尚不清楚。
MAPK的激活
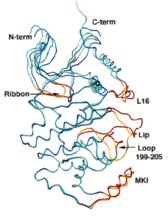 MAPK
MAPKMAPK的活性被認為是由活化環的胺基酸序列中的雙磷酸化位點所調控。MAPK活化環中的TXY序列是特定的MKK催化進行雙磷酸化反應的位點。對於ERK/ERK2來說,雙磷酸化位點是Thr和Tyr。這些位點的雙磷酸化使MAPK的活性增加一千倍以上。