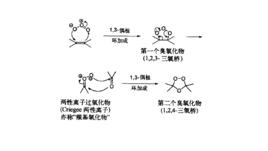
反應機理
臭氧先對烯烴進行1,3-偶極環加成得到初級臭氧化物,重排得到兩性離子過氧化物,再一次1,3-偶極環加成生成最終的臭氧化物。
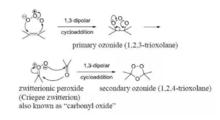 反應機理
反應機理反應實例
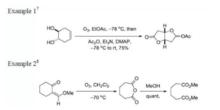 反應實例
反應實例環加成反應
兩個共軛體系結合成環狀分子的一種雙分子反應。通過環加成反應,兩個共軛體系分子的端基碳原子彼此頭尾相接,形成兩個σ鍵,使這兩個分子結合成一個較大的環狀分子,例如丁二烯與乙烯(或它們的衍生物)的加成反應。
環加成反應也是套用分子軌道對稱守恆原理討論立體化學特徵的典型反應。在環加成反應中形成σ鍵時,對於每一對端基的碳原子都可以按照同面或異面的方式進行。如果共軛多烯反應物有取代基,則產物分子可能具有不同的、可辨認的立體化學結構特徵。
對於同面方式,產物中A和A'在環平面的同一側,C和C'在同一側。對於異面方式,A和B'在同一側,C和D'在同一側。式中僅示出A和C在同一側的同面和異面方式反應的情況,也可以類似地討論A和C在異側的同面和異面方式反應的情況。
按分子軌道對稱守恆原理可確定環加成反應進行的主要方式如下:當兩個反應分子中共軛碳原子數之和為4的整數倍時,熱化學反應主要按同面-異面或異面-同面方式進行,光化學反應主要按同面-同面或異面-異面方式進行;當兩個反應分子中共軛碳原子數之和為非4整數倍的偶數時,則熱化學反應主要按同面-同面或異面-異面方式進行,光化學反應主要按同面-異面或異面 - 同面方式進行 。例如,狄爾斯-阿爾德反應的共軛碳原子之和為6,是非4整數倍的偶數,因此其熱化學反應主要按同面-同面或異面-異面方式進行。