特點
CIK細胞中的效應細胞CD3+CD56+細胞在正常人外周血中極其罕見,僅1%~5%,在體外經多因子培養28~30天,CD3+CD56+細胞迅速增多,較培養前升幅可達1000倍以上。實驗證明,擴增出的CD3+CD56+細胞來源於CD3+CD56-T細胞,而非CD3-CD56+NK細胞。同時發現在CD3+CD56-的T 細胞中,除CD4+CD8-T細胞外,其餘三種T 細胞亞群(CD4-CD8+、CD4-CD8-、CD4+CD8+)均可通過體外多因子培養而獲得CD56分子的表達,而由於CD4+CD8+細胞和CD4-CD8-細胞在正常人外周血中含量極低而間接提示此CD3+CD56+細胞絕大多數來源於外周血中CD4-CD8+T細胞。而由於CD4-CD8-T細胞在培養1個月後有近56%的T 細胞同時表達CD56和CD3,表明其也是CIK細胞的重要來源。比較CD3+CD56+CIK細胞中表達CD8+和CD8-,的兩群細胞其殺瘤活性沒有顯著性差異,提示CIK細胞的細胞毒性與CD3CD56表達成相關趨勢,而與CD8的表達未表現出相關性。
1.CIK細胞增殖速度快,抗腫瘤活性細胞可大量增殖,且細胞活性也大大增強。
2.CIK細胞具有識別腫瘤的機制,對正常的細胞無毒性作用。
3.殺瘤譜廣,可用於白血病、淋巴瘤、肺癌、胃癌、腸癌等多種腫瘤的治療,對多重耐藥腫瘤細胞同樣敏感。
4.是典型的個性化生物治療模式。將這類細胞回輸後,還能使機體免疫能力提高,產生特異的抗病毒作用,從而對腫瘤治療施以雙重的作用。
5.由於CIK細胞是活化的自體細胞,用起來非常安全。
殺傷原理
 CIK
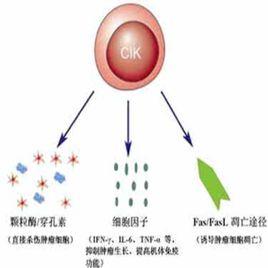
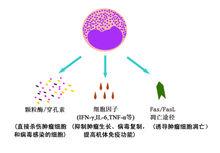
CIKCIK細胞能夠通過三種途徑殺滅腫瘤細胞和病毒感染細胞:①CIK細胞對腫瘤細胞和病毒感染細胞的直接殺傷:CIK細胞可以通過不同的機制識別腫瘤細胞,釋放顆粒酶/穿孔素等毒性顆粒,導致腫瘤細胞裂解。
②CIK細胞釋放的大量炎性細胞因子具有抑瘤殺瘤活性:體外培養的CIK細胞可以分泌多種細胞因子,如IFN-γ、TNF-α、IL-2等,不僅對腫瘤細胞有直接抑制作用,還可通過調節機體免疫系統反應性間接殺傷腫瘤細胞。
 CIK細胞發揮作用的三種途徑
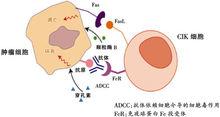
CIK細胞發揮作用的三種途徑③CIK細胞能夠誘導腫瘤細胞的凋亡:CIK細胞在培養過程中表達FasL(Ⅱ型跨膜糖蛋白)通過與腫瘤細胞膜表達的Fas(Ⅰ型跨膜糖蛋白)結合,誘導腫瘤細胞凋亡。
殺瘤特點
套用LAK細胞是當今較為普及的腫瘤過繼免疫治療方案,廣泛使用於黑色素瘤、腎細胞癌、非霍奇金淋巴瘤、肺癌和結腸癌。因LAK細胞擴增數量有限,殺瘤活性也較TIL等T 淋巴細胞為低,故雖然殺瘤譜廣,但效果局限。相比較而言,TIL 細胞本身較LAK細胞具有更強大的抗瘤效力,但由於殺瘤譜窄,製備困難,及在收集過程中可能導致的功能改變而限制了其臨床套用價值。與上述兩種效應細胞過繼免疫治療相比,CIK細胞具有獨特的優勢,列舉如下。
1. 增殖速度快
CIK細胞在培養過程中加入IFN-γ、IL-1α、抗CD3、McAb、IL-2等多因子後,細胞增殖速度迅速加快,遠超過LAK細胞。在培養第22天增殖曲線達頂峰,約增加100倍,其中CD3+CD56+細胞不僅絕對數量增加1000倍以上,且所占百分比也大幅上升,培養至28~30天時達平台期,細胞毒活性亦達峰值,而LAK細胞培養前後數量沒有明顯增加。
2. 殺瘤活性高
CIK細胞是以CD3+CD56+T細胞為主的異質細胞群,大量體內外實驗證實CIK細胞較以NK細胞為主的LAK細胞具備更強大的殺瘤活性,而且其體內殺瘤細胞毒性的維持不必依賴大劑量外源性IL-2的持續給予。體外實驗中,任歡和Lu等均發現在體外等數量的CIK細胞比LAK細胞對腫瘤細胞系的殺傷能力稍高或相近,但因CIK細胞在培養過程中CD3+CD56+效應細胞增長迅速,故CIK細胞的總殺傷單位(TLU)為LAK 細胞的73倍甚至更高,其殺傷效率顯著高於LAK細胞。腫瘤克隆抑制實驗顯示,CIK細胞的瘤細胞抑制Log指數為2.5~3.5,較LAK細胞的瘤細胞抑制指數高2個Log。體內實驗發現,對於在嚴重聯合免疫缺陷小鼠身上構建的人類B 細胞淋巴瘤SU-DHL4模型,CIK細胞在清除荷瘤鼠體內腫瘤病灶,抑制轉移,延長生存期等方面的作用均明顯優於LAK細胞。
3. 殺瘤譜廣
CIK細胞雖然以CD3+CD56+ T細胞為主要效應細胞,但卻沒有T 淋巴細胞殺傷時的MHC 限制性,故對於多種腫瘤細胞系(包括NK敏感的K562和NK不敏感的Hela、HL60、人T 細胞急淋白血病細胞系OCRF-CEM,人淋巴瘤細胞系OCI-LY8、LAM53,人結腸癌細胞系HT-29、CR75,人腎癌細胞系A704)和新鮮腫瘤組織均表現出強大的殺傷活性。
4. 對多重耐藥腫瘤細胞同樣敏感
Wolf用阿黴素和長春新鹼誘導出多重耐藥細胞系K562/DOX和CCRF-CEM-VBL,發現CIK細胞對化療藥物敏感的親本細胞和不敏感的轉化細胞均具有強大的殺傷活性,兩者比較無差別。
5. 殺瘤活性不受CsA、FK506等免疫抑制劑的影響
Mehta觀察到免疫抑制劑CsA和FK506雖然可以抑制抗CD3單抗介導的CIK細胞脫顆粒過程,卻不影響靶細胞誘導的CIK細胞脫顆粒,並且CIK細胞對靶細胞的殺傷活性不會因此降低。
6. 對正常骨髓造血前體細胞毒性很小
Seheffold通過CFU-GM形成實驗檢測CIK細胞對骨髓造血前體細胞的影響,發現CIK細胞對K562細胞的殺傷強度高達3級,但對GM-CFU僅有不足1級的抑制。
Holye也證實CIK細胞對正常髓系克隆生成幾乎沒有影響,只是對紅系的生成顯示出輕度抑制,這可能與CIK細胞自身分泌較高水平的IFN-γ有關。
7. 能抵抗腫瘤細胞引發的效應細胞Fas-FasL凋亡
已證明過繼免疫治療失敗的一個重要原因是過繼效應細胞被腫瘤細胞表面表達的某些蛋白(主要是FasL)誘導凋亡,而CIK細胞雖然在Fas被占據後會引起少量細胞凋亡,但對其殺瘤細胞毒性沒有明顯影響。Verneris的實驗提示CIK細胞內有抗凋亡基因表達,並檢出多種保護基因,如cFLIP、Bcl-2、Bcl-X1、DAD1和survivin的轉錄水平上調。同時發現CIK細胞具備合成FasL的能力,CIK細胞培養上清中可以檢測到具生物學活性的水溶性FasL,表明CIK細胞可以對抗體內FasL 陽性腫瘤所引發的效應細胞活性下降甚至消失。
影響因素
1.外源性細胞因子的補充
CIK細胞的體外擴增需要外源性細胞因子,如IL-2、IL-7、IL-12等的輔助,這些因子控制著人免疫系統內各種抗原特異性細胞的擴增及其生物學活性。外源性IL-2、IL-7、IL-12可以顯著促進淋巴細胞的生長,尤其存在有IL-2和IL-7條件下CIK細胞的增殖率為高,而外源性, IL-2、IL-7、IL-12對CIK細胞的細胞毒活性沒有影響。外源性IL-2和IL-7的刺激會降低CIK細胞表面相應受體的表達量,而CD28分子在IL-7存在條件下較IL-2時表達更高。IL-12會降低CIK細胞表面ICAM-1的表達,IL-7則會提高CD56的表達。與IL-2相比,IL-7可明顯增加CD4+細胞的比例。雖然外源性IL-2、IL-7和IL-12培養過程中均可出現少量凋亡細胞,但有研究顯示外源性IL-12的添加會增加CIK細胞中壞死細胞的比例。
抗CD3McAb不僅在CIK細胞培養過程中起著重要作用,在提高CIK細胞對白血病及淋巴瘤的殺傷敏感性上同樣具有促進作用。Lefterov將抗CD3McAb與靶細胞預先共同孵育可增加CIK細胞對其的殺傷敏感性,而且這種增強作用可以被抗FcR的抗體(如抗CD36、抗CD32)所部分阻斷,間接證明抗CD3McAb引發的殺傷活性增高與FcR介導的抗體結合有關。
2.多種細胞因子基因的轉染
由於CIK細胞擴增對外源性細胞因子有依賴,因此通過基因轉移方法將相關基因轉入CIK細胞,不僅可減少外源性細胞因子的使用量,還可提高CIK細胞自身的抗瘤活性。
IL-7:Fitke利用改進的腺病毒轉基因系統將人IL-7基因轉染CIK細胞,發現轉染後細胞可以生成較高濃度IL-7,最多者可達1 100pg/106cell/24h。合成的IL-7具有明顯的生物學活性,可以促進轉染CIK細胞的增殖,顯著高於未轉染細胞。外源IL-7基因的表達同時改變了CIK細胞對其他細胞因子的分泌,其中尤以TNF-α分泌顯著升高,這一現象在未轉染CIK體外添加IL-7時並未觀測到。雖然轉染後CIK細胞表面各種與細胞殺傷活性相關的表面抗原,如ICAM-1 等與未轉染CIK細胞相比無明顯變化,但轉染後CIK細胞在對多種腫瘤細胞系如腎癌、惡性黑色素瘤以及結腸癌的殺傷能力較未轉染CIK細胞有明顯增強。
IL-2:Lu等發現CIK細胞培養過程中CD56分子的表達是IL-2依賴性的,但單獨IL-2的存在卻會降低培養後CIK細胞的表型變化幅度。儘管有實驗指出CIK細胞的體內治療並不需要IL-2體外持續供給,但Zoll等的研究結果表明,體外培養中IL-2對CIK細胞的增殖和殺傷功能有促進作用。Schmidt-Wolf將包含人IL-2基因片段的重組質粒用電穿孔法導入CIK細胞治療轉移性實體瘤,發現轉染後細胞可分泌較高水平的IL-2(330-1 800pg/106 cell/24h,平均達836pg/106 cell/24h )。雖然轉染前後CIK細胞表面各種膜蛋白表達並無顯著變化,但體外檢測轉染後CIK 細胞在增殖率和細胞殺傷活性上均高於未轉染細胞。
製備流程
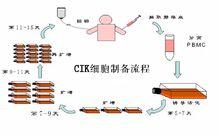 CIK細胞製備流程
CIK細胞製備流程抽取患者的外周血,在37℃,5%的二氧化碳培養箱中孵育2h,使用高速離心機分離,收集懸浮細胞,在體外(模擬人體內環境),加入多種細胞因子如CD3單抗,IFN-R,IL-2等培養,每隔2-3天換一次培養液,第7、11、13、15天收集CIK細胞,CD3+和CD56+細胞迅速增多,較培養前升幅可達1000倍以上。
發展歷程
1985年美國外科醫生首次發現大劑量的IL-2在體外可以將淋巴細胞培養成具有很強腫瘤殺傷作用的細胞,稱為LAK細胞。以後發現在培養液中加入CD3單克隆抗體可以將這些細胞的腫瘤殺傷活性提高十幾倍,擴增的數量也大幅提高,這種細胞稱為CD3AK。在這個基礎上再在培養液中加入INF-r、IL-1等細胞因子,得到表達CD3\CD8\CD56陽性的異質細胞群,這些細胞稱為CIK,相比LAK細胞增殖倍數更多,防毒活力更強。
1991年美國史丹福大學Schmidt Wolf等人首次報導了CIK細胞。
臨床套用
早在1996年國內已有CIK細胞治療技術臨床套用的研究論文發表,目前國內已有超過百家的醫療單位開展了該項治療技術的相關臨床套用與研究。
根據國際國內細胞治療臨床套用的進展狀況,2009年5月1日衛生部頒發執行的《醫療技術臨床管理套用辦法》將“自體免疫細胞治療技術”列為三類醫療技術。
肝癌患者接受手術聯合CIK治療後1年、3年、5年的無病生存期比較,具體如圖:
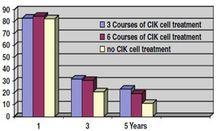 CIK
CIK適應症
CIK細胞治療屬於過繼細胞免疫療法,由於CIK細胞溶瘤作用是非MHC限制性的,即不受腫瘤組織類型的限制,因此對任何一種腫瘤均有殺傷作用,但對高抗原表達的癌症療效最好,如:髓性白血病、黑色素瘤、腎細胞癌、轉移性腎癌、非何杰金氏淋巴瘤等。其它癌症如肺癌、結腸癌、乳腺癌、肝癌、胃癌、大腸癌等,CIK細胞治療亦有較好的療效。CIK細胞治療適用於任何一期的癌症患者,但對早期腫瘤患者或經過手術及放化療後腫瘤負荷較小的患者效果好。它對於手術、放化療或造血幹細胞移植後患者體內微小殘留病灶的清除,防止癌細胞擴散和復發,提高患者自身免疫力,減少毒性反應等方面具有重要作用。某些不適合手術、不能耐受放化療的中晚期腫瘤患者,CIK細胞治療可以提高其生活質量,延長帶瘤生存時間。
CIK 細胞通過直接殺傷、分泌多種細胞因子等直接抑制腫瘤細胞生長,誘導腫瘤細胞凋亡起到治療作用。大多數執行殺傷功能的細胞在回輸後立即執行其功能,半衰期約2周至一個月。回輸的細胞中包括一部分記憶細胞,可存活幾年至幾十年,當遇到相應刺激後,迅速在體內活化,殺傷靶細胞。所以CIK細胞治療的療程間隔原則上為一個月,建議首先間隔一個月連續做三個療程,以後每半年做一個療程。
基本定義二:
CIK是一家公司的股票代碼,是Credit Suisse Asset Mgmt Fd 的縮寫。