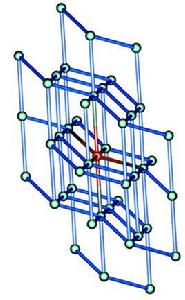
定義
標準狀況下,拆開單位物質的量的離子晶體使其變為氣態組分離子所需吸收的能量,稱為離子晶體的晶格能。
晶格能越大,熔化或破壞離子晶體時消耗的能量就越大,相應的熔點就越高,硬度就較大。亞銅離子為18電子構型,鈉離子為8電子構型,亞銅離子的極化作用大於鈉離子,所以共價鍵成分更多,晶格能更小,熔沸點更低。因此UCu2S<UNa2S
點陣能
點陣能是衡量晶體中離子間或分子間鍵結合能大小的一個量度,是闡明晶體物理、化學性質的重要物理量。分子晶體的點陣能因以分子間作用力為基礎,比離子晶體的點陣能要小得多。例如,分子氮晶體的點陣能是7.1千焦/摩爾,而離子晶體氯化鈉的點陣能為757.3千焦/摩爾。
測定
晶格能較難由實驗直接測定,但可根據玻恩(M. Born)-哈伯(F. Haber)熱化學循環,由金屬元素m(氣體)的電離能、非金屬元素x(氣體)的電子親和能、M(晶體)的升華熱和MX;(晶體)的生成熱等間接推算出由氣態M+與X-生成1molMX晶體的晶格能。對各類二元離子型晶體,其晶格能一般不難由理論計算導出。
理論公式
M.玻恩和A.朗德在1918年提出了二元型離子晶體點陣能的理論公式式中( N為阿伏伽德羅數; m為與離子電子構型有關的玻恩指數; r0為最鄰近的正、負離子的平衡距離<即離子鍵長>; w+和 w-為正、負離子的電價; e為電子的電量; α為馬德倫常數),它與離子晶體的結構類型有關,例如,氯化鈉型和立方硫化鋅型晶體的 α值分別為1.748與1.638。
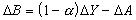 公式
公式