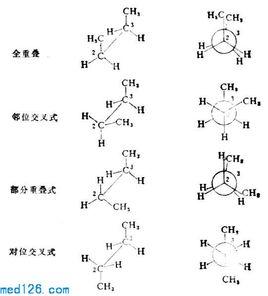
定義
單鍵旋轉時,相鄰碳上的其他鍵會交叉成一定的角度,稱為扭轉角(torsionangle)。扭轉角是0°的構象為重疊構象,扭轉角是60°的構象是鄰位交叉構象,也叫順錯構象,扭轉角在0-60°之間的構象為扭曲構象(skewedconformation)。
相關概念
構型和構象
構型(configuration)指分子內原子或基團在空間“固定”排列關係,分為:順反異構,旋光異構二種。
構象(conformation)指圍繞單鍵旋轉產生的不同的分子形象。
構型和構象在有機合成、天然產物、生物化學等研究領域非常重要。例如六六六有九種順反異構體,其中只有γ-異構體具有殺蟲活性。
人體需要多種胺基酸,其中只有L-型具有活性作用。
手性(chiral)在醫藥、農藥、食品添加劑、香料等領域需求越來越多。手性液晶材料、手性高分子材料具有獨特的理化性能,成為特殊的器件材料。一個新興的高新技術產業-手性技術(chirotechnology)正在悄然興起。
順反異構
由於雙鍵或環的存在,使得旋轉發生困難,而引起的異構現象。
命名:順、反 (Cis,Syn-;Trans, Anti)。 現在用 “Z”, “E”表示。
Z:Zusammen 二個大的基團都在一側(相當於順) E:Entgegen 二個大的基團分在兩側 (相當於反)
關於C=N和N=N雙鍵的命名
含C=N雙鍵的化合物主要是指醛肟和酮肟(醛或酮與羥胺NH2OH反應得到)
孤對電子的序數為“0”。
文獻上,現在還沿用順、反命名。把-OH,-H在一側的叫順式,Cis-,Syn-;把-OH,-H在兩側的叫反式,Trans-,Anti-。
N=N雙鍵也用順反命名:一般反式穩定,減少了基團間的排斥作用。
(反式對稱性好,分子排列更為緊密、有序,有較高的熔點,較低的溶解度(在水中,因極性小),燃燒熱、氫化熱比順式低。
對於環狀化合物仍用順反而不用E、Z,把環看成是一個平面的,取代基團在同一側的為順式。 如果有三個以上時,選一個參考基,用小寫r(reference group)表示,再和別的取代基比較與之關係。
對映異構
手性分子(chiral molecule)、手性碳,從上世紀七十年代起廣泛使用,能夠使平面偏振光向左或向右旋的物質稱為旋光性物質(或光活性物質)。
手性分子是指一個分子與其鏡象不能重合。 手性分子一定是光活性物質。
對映異構體:二個互為鏡象,但不能重合,是二種不同化合物。旋光能力相同,但方向相反,如同左、右手。
考察一個分子是否為手性分子,可以從有無手性碳出發,但是最根本是要看分子對稱性來考察。
符合手性分子的充要條件:
①無對稱面; ②無對稱中心; ③無交換對稱軸。
三者不可缺一,但一般說來,只要求分子是否有對稱面或對稱中心即可了。(注意:對稱軸不能作為判據。)
構象和構象分析
構象:沿C-C單鍵旋轉,分子產生不同形象,稱為構象。
單鍵旋轉能壘一般為3~10千卡/摩爾,在室溫下熱運動可以越過此能壘,各種構象迅速互變,分子在某一構象停留時間很短(﹤10-6秒),因此不可能將某一個構象分離出來。
研究構象對於了解化合物結構、反應歷程和反應取向等方面非常重要。 許多分子呈現有張力,就是由於非理想幾何形狀造成的。分子將儘可能利用鍵角或鍵長的改變使能量達到最低值,就是說一個分子總是要採取使其能量為最低的幾何形狀。
分子內張力
空間張力=成鍵張力(單鍵伸長或縮短)+鍵角張力+扭轉張力+非鍵張力
分子內張力是上述四種張力之和。
1、 角張力(亦稱Baeger張力):它是由於正常鍵角改變產生的。
2、 鍵張力:是由鍵的伸縮使正常鍵長改變而產生的張力。
3、扭轉張力(pitzer張力):它是由於優勢構象二面角改變而產生的張力。兩個連線四面體碳原子,他們都傾向於成為交叉式,與交叉式任何偏差都會引起一定張力,希望恢復到交叉式的最穩狀態,這種張力就是扭轉張力。
4、非鍵張力(范德華張力):非鍵合的原子或基團相互作用。
在小環化合物中(3~4元環)主要存在有角張力;普通環(5~7元環)各種張力都不顯著,6元環無角張力、無扭轉張力。 在中環(8~11元環)主要存有跨環張力。在大部分環狀化合物中(除大環外)大部分存在扭轉張力。
丁烷的構象
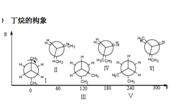 順錯構象
順錯構象Ⅰ對位交叉,Ⅱ部分重疊,Ⅲ鄰位交叉,Ⅳ全重疊式,Ⅴ鄰位交叉,Ⅵ部分重疊
Ⅰ為優勢構象
從丁烷的勢能圖可見,有三個能量極大值,全重疊式為最大值;三個能量極小值,對位交叉為最小值。
穩定性次序:對位交叉﹥鄰位交叉﹥部分重疊﹥全重疊
兩個鄰位交叉Ⅲ、Ⅴ比對位交叉式略高0.8kcal/mol,是由於甲基之間的排斥作用,但由於能量相差不大,在室溫下,兩者都可存在。對位交叉占68%,鄰位交叉占32%。
正丁烷體系不能分離出單一的構象異構體,他們這類化合物的性質是各種構象異構體的平均值。
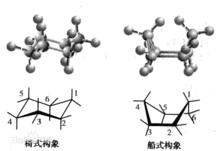
環己烷構象
環己烷構象(cyclohexane conformation),可分椅式(chair)、船式(boat)、扭船式以及半椅式。
 順錯構象
順錯構象若環己烷分子中碳原子在同一平面上時,其C—C鍵角為120度,存在較大的角張力。實際上分子自動折曲而形成非平面的構象,在一系列構象的動態平衡中,椅式構象(chair conformation)和船式構象(boat conform ation)是兩種典型的構象。在常溫下,由於分子的熱運動可使船式和椅式兩種構象互相轉變,因此不能拆分環己烷的船式或府式中的某一種構象異構體。
構象對化學反應速度的影響
(1) 酯的水解
反式比順式在鹼性條件下水解快20倍。 鹼性、酸性水解,四面體機制。 鹼性水解條件下,HO-進攻羰基碳。
在反式酯中,形成過渡態中,空間比較寬敞,有利。
而在順式酯形成的過渡態中,雙1,3相互排斥,過於擁擠,不利。
(2)環己酮的還原
用LiAlH4-t-BuOH、NaBH、Na醇等作為還原劑時,真正的還原劑H-體積小,從羰基兩側進攻機會相當,由於e醇比較穩定,反應受“產物生成控制”。此時a 9%,e 91%。
如果還原劑為或BH(CHMeCHMe2)2,其體積比較大,則產物以a-OH為主,反應受“立體途徑控制”。
構象對分子物化性質的影響
分子的構象不僅影響化合物的物理和化學性質,而且還對一些生物大分子(如蛋白質、酶、核酸)的結構和性能產生影響。許多藥物分子的構象異構與藥物生物活性密切相關,藥物受體一般只與藥物多種構象中的一種結合,這種構象稱為藥效構象。藥物的非藥效構象異構體很難與藥物的受體結合,通常低效或無藥效。例如,抗篾顫麻痹藥物多巴胺作用於受體的藥效構象是對位交叉式。