背景知識
分子軌道理論:分子軌道理論又稱分子軌道法(Molecular Orbital Theory)或MO法,1932年由美國化學家密立根(R.S.Mulliken)及德國物理學家洪特(F.Hund)提出。是現代共價鍵理論之一。它的要點是:從分子的整體性來討論分子的結構,認為原子形成分子後,電子不再屬於個別的原子軌道,而是屬於整個分子的分子軌道,分子軌道是多中心的;分子軌道由原子軌道組合而成,形成分子軌道時遵從能量近似原則、對稱性一致(匹配)原則、最大重疊原則,即通常說的“成鍵三原則”;在分子中電子填充分子軌道的原則也服從能量最低原理、泡利不相容原理和洪特規則。
π鍵:原子軌道垂直於鍵軸以“肩並肩”方式重疊所形成的化學鍵稱為π 鍵。形 成π 鍵時,原子軌道的重疊部分對等地分布在包括鍵軸在內的平面上、下兩側,形狀相同,符號相反,呈鏡面反對稱。名字中的希臘字母π代表了p軌道,因為π鍵的軌道對稱性與p軌域相同。p軌道通常參與形成π鍵,然而,d軌道同樣能參與形成。
σ鍵:原子軌道沿鍵軸(兩原子核間連線)方向以“頭碰頭”方式重疊所形成的共價鍵稱為σ鍵。形 成σ鍵時,原子軌道的重疊部分對於鍵軸呈圓柱形對稱,沿鍵軸方向旋轉任意角度,軌道的形狀和符號均不改變。由於形成σ鍵時成鍵原子軌道沿鍵軸方向重疊,達到了最大程度的重疊,所 以σ鍵的鍵能大,穩定性高。
簡介
電荷轉移絡合物的形成是因其中有一個分子的作用像一個電子給體D,而另一個分子的作用則像一個電子受體A。
下圖表示D和A二個分子相互靠近結合;
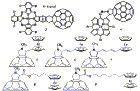 電子給體受體絡合物
電子給體受體絡合物下圖表示電子已從D轉移到A中。苯可以看作是一個電子給體,碘則可看作是一個電子受體。
 電子給體受體絡合物
電子給體受體絡合物電荷轉移絡合物往往有顏色,有許多是不穩定的,它們只能在溶液中與它們的組分以平衡狀態存在。有一些電荷轉移絡合物可形成穩定的固體,有一定的熔點。例如,等摩爾的對苯醌和對苯二酚混合,可生成暗綠色的“醌氫醌”結晶,其熔點為171℃。許多電荷轉移絡合物中的電子給體和電子受體分子間之比是正整數,多數是1:1。具有非整數比的電荷轉移絡合物也有發現。
類型
①電子受體是金屬離子,電子給體是烯烴或芳環。許多金屬離子能與烯烴、雙烯(一般是共軛雙烯)和芳環生成絡合物,常是穩定的固體。根據J.杜瓦的意見,這類絡合物形成如下形式的化學鍵:在金屬離子和烯烴之間形成兩個鍵;一個是由烯烴充滿電子的 π2p軌道與金屬離子的空s軌道(Ag+為5s軌道) 相互重疊生成的σ型鍵;另一個是由金屬離子充滿電子的d軌道(Ag+為4d軌道)與烯烴的空反鍵π壘 軌道相互重疊而生成的π 型鍵。這種形式的鍵使得金屬離子不是與一個原子成鍵而是與整個π 鍵中心成鍵,結果是烯烴的電子密度有一部分移向金屬離子。
 電子給體受體絡合物
電子給體受體絡合物②電子受體是有機分子,例如苦味酸、1,3,5-三硝基苯、2,4,7-三硝基芴(結構式如)和類似的多硝基化合物。苦味酸能與許多芳烴、芳胺、脂肪胺、烯烴和另外一些化合物形成加成產物(見加成反應)。這些加成產物常是固體並有一定的熔點。這類化合物成鍵的原理尚不清楚,有一個理論認為它們有下列共振:
此外由晶體的X衍射測定發現,有許多這類加成產物,它們的分子相互平行地堆集在一起,含有給電子分子和受電子分子的交替層。例如三硝基苯-聯苯胺,在這種絡合物中,取代基團不相互接近,苯環也不相互重疊。生成這類絡合物的一個重要條件是苯環本身的共平面性。
③電子受體是碘、溴或氯。鹵素分子從給電子體接受電子,並充實到它們的外電子d層,使它達到10個電子。胺、芳烴、酮等都能與鹵素分子生成絡合物。這就是碘溶解在丙酮、乙醇或苯等溶劑中而不產生碘的正常紫色的原因。IBr和ICl也可以形成絡合物,分子中I端是分子的電子受體。
套用
①做太陽能電池的材料,苝的衍生物及其四氰基對醌二甲烷電荷轉移絡合物已用於太陽能電池。
②做電解質電容器的電解質添加劑,4-氰基-N-甲基吡啶碘?鹽與四氰基對醌二甲烷的電荷轉移絡合物,可提高電解質電容器的電容量。鹵代苯醌與酞花青和二氨基萘與芘形成的電荷轉移絡合物,可改進絕緣性能。
③做表面活性劑。
④做半導體塑膠、鋰蓄電池陽極區中的添加劑、紅外顯像管中的導電熱敏聚合物和熱塑鑄模時用的抗靜電劑。

