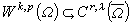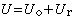離子締合
這種新單元稱離子對,它有足夠的穩定性,持續的時間足夠長,在溶液中是一個運動實體。離子締合概念是1926年由N.J.布耶魯姆提出的,他認為一個電解質可以百分之百地電離,但不一定百分之百地離解。締合作用力是純粹庫侖力,設臨界距離q為: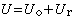
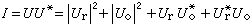
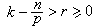
對一定體積的電解質溶液,選定一個中心離子j,按照離子間的靜電作用能,套用玻耳茲曼分布定律,計算異號離子i在離中心離子的距離為 a至q的殼層中出現的總幾率,它就是離子j和i的締合度。套用質量作用定律,可求得離子對的離解常數K:
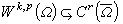
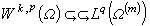 ;Q(b)為b的函式;NA為阿伏伽德羅數。
;Q(b)為b的函式;NA為阿伏伽德羅數。 R.M.弗斯假設正離子是具有半徑 a(即離子最近距離)的圓球導體,負離子是帶電的質點,能夠穿入正離子圓球。離子對的定義是含有負離子在內的正離子圓球。考慮溶液和正離子的體積,套用玻耳茲曼分布定律,計算形成離子對和負離子形成自由離子的幾率,得出離子對離解常數K為: