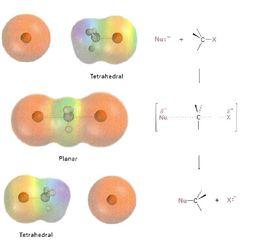
反應機理
SN2反應最常發生在脂肪族sp 雜化的碳原子上,碳原子與一個電負性強、穩定的離去基團(-X)相連,一般為鹵素陰離子。親核試劑(Nu)從離去基團的正後方進攻碳原子,Nu-C-X角度為180°,以使其孤對電子與C-X鍵的σ反鍵軌道可以達到最大重疊。然後形成一個五配位的反應過渡態,碳約為sp 雜化,用兩個垂直於平面的 p軌道分別與離去基團和親核試劑成鍵。C-X的斷裂與新的C-Nu鍵的形成是同時的,-X很快離去,形成含C-Nu鍵的新化合物。
 SN2與SN1的對比
SN2與SN1的對比2-溴丁烷與氫氧根離子發生SN2生成2-丁醇和溴離子。
上例中,OH (親核試劑)進攻2-溴丁烷(底物)發生SN2反應,經過不穩定的過渡態,最終Br 離去,得到2-丁醇。
SN2反應也可以在分子內發生,合成的環系一般為五元環、六元環和三元環。分子內的Williamson合成得到環氧化合物,即是這類反應的一個例子。
相比下,四元環張力太大,空間上也不利,很難生成;七元、八元之類的大環可以生成,但分子間反應處於優勢,需要將反應物以高稀溶液的形式反應,以增大分子內產物的比例。
SN2反應一般發生在伯碳原子上,很難成為有位阻分子的反應機理,並且取代基越多,按SN2機理反應的可能性越小。基團在空間上比較擁擠的分子一般採用SN1機理,可以緩解一部分的位阻,也可生成較穩定的碳正離子(通常為三級碳正離子)。
由於親核試劑是從離去基團的背面進攻,故如果受進攻的原子具有手性,則反應後手性原子的立體化學發生構型翻轉,也稱“瓦爾登翻轉”。這也是SN2反應在立體化學上的重要特徵。反應過程類似於大風將雨傘由里向外翻轉。
決定速率的因素
離去基團的鹼性
離去基團的鹼性越強,其離去能力越弱,反之亦然。離子的鹼性隨著所在周期的增加而降低。對於鹵素離子而言,碘離子的鹼性最弱,因此碘離子是一個很好的離去基團;氟離子則相反,氟代烴也因此很難發生SN2反應。鹼性 F > Cl > Br > I ,離去能力與上述順序相反。
親核試劑的親核性
親核性需要與上面的鹼性相區別。鹼性是試劑對質子的親和能力,而親核性是試劑形成過渡態時,對碳原子的親和能力。一般來講,試劑的負電性、鹼性和可極化性越強,其親核性也越強。實際上通常需要綜合考慮這幾個因素以及溶劑的影響。
溶劑
SN2反應在質子溶劑中進行時,一方面,溶劑化作用有利於離去集團的離去;另一方面,溶劑也會與親核試劑發生作用,使親核試劑與底物的接觸變得困難。最後的影響是這兩種因素的綜合結果。相對而言,非極性溶劑分子很少包圍負離子,因此對SN2反應是有利的。
空間效應
位阻(含體積大的取代基)會使親核試劑的親核性下降。雖然乙醇的酸性比叔丁醇強,但叔丁氧基負離子的親核性弱於乙氧基負離子,就是因為這個緣故。
反應動力學
SN2屬於二級反應,決速步與兩個反應物的濃度相關:親核試劑[Nu]和底物[RX]。
r = k[RX][Nu]
與此相對比的是單分子親核取代反應—SN1反應,親核取代反應的另一種機理。此類反應中,底物中的C-X鍵首先異裂為碳正離子和X ,是較慢的一步,然後親核試劑Nu立即與碳正離子結合,得到含C-Nu鍵的產物。因此該反應的速率控制步驟只和底物的濃度有關,稱為單分子親核取代反應。
需要注意的是,SN1和SN2隻是親核取代反應的兩個比較極端的機理,屬於理想情況。在因素如離子對的影響下,實際中的反應都會或多或少地兼具這兩者機理的成分,有些甚至難以歸類。
至於反應按哪種機理進行的成分多一些,與具體的反應物結構、類型、溶劑、濃度、溫度、親核試劑、離去基團等因素都有很密切的關係。