反應原理
 雙分子反應
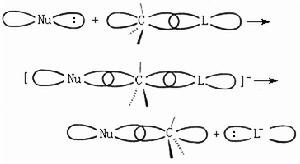
雙分子反應由於有兩個反應物分子參與了過渡態的形成,反應速率既取決於RL,也取決於Nu,所以將按這種過程進行的反應稱為雙分子親核取代反應SN2(S代表取代,N代表親核,2代表雙分子)。在SN2反應中親核試劑是從離去基團的背面進攻中心碳原子,因而會引起手性碳原子的構型轉化。
隨著反應的進行,碳原子由sp雜化變成sp雜化,碳原子上p軌道分別與親核試劑和離去基團的電子云重疊,然後碳原子由sp雜化變成sp雜化,同時發生構型轉化。
雙分子反應的反應速率(r)與反應物的濃度和親核試劑的濃度成正比:r=k【RL】【Nu】。
式中k為反應速率常數。例如,一級鹵代烴在極性較小的溶劑(如丙酮)中的鹼性水解:NaOH+CH3Cl─→CH3OH+NaCl
r=k1【CH3Cl】【NaOH】。
誘導機制
在雙分子親核取代反應中,反應物不傾向於離解成正碳離子中間體,這是結構因素和反應條件所決定的。溶劑的極性不夠強時,親核試劑易於接近碳而形成過渡態。
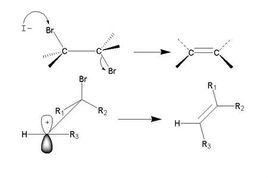
在消除反應中,在試劑進攻β碳原子上的氫原子的同時,離去基團帶著一對電子離去,在兩個碳原子之間生成烯鍵,例如:
β位的H-C鍵和α位的C-Br鍵的斷裂與雙鍵的生成是協同進行的。在決定反應速率步驟中有反應物分子和試劑參加,因此稱為雙分子消除反應E2(E代表消除,2代表雙分子)。E2反應為一步反應,其速率與反應物的濃度和試劑的濃度成正比:r=k【CH3CH2Br】【C2H5O】。
在E2反應中,試劑還可以進攻α碳原子,生成取代產物。因此E2和SN2反應常同時發生,二者相互競爭。
例子
例如,在親核取代反應過程中,中心碳原子與離去基團L:相連的鍵斷裂,而親核試劑Nu:與中心碳原子構成了新鍵,在這一步反應中,親核試劑從離去基團的背面進攻中心碳原子,當親核試劑逐漸與中心碳原子接近而構成新鍵的同時,離去基團被逐漸推出中心碳原子而使原有的鍵斷裂,二者是協同進行的。Nu:+RL─→【Nu…R…L】─→Nu-R+:L。