正文
 鉻酸鹽
鉻酸鹽化學通式M姟CrO4或MⅡCrO4(MⅠ為一價金屬,MⅡ為二價金屬)。
鉻酸鹽在酸性溶液中有以下平衡:
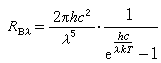
平衡常數 K=1014,表明在酸性溶液中Cr2O崻占優勢;在鹼性溶液中CrO娸占優勢。兩種離子之間的相互轉化,取決於溶液的pH值。酸的濃度增大時,Cr2O崻還可進一步聚合成三鉻酸鹽Cr3O崠和四鉻酸鹽Cr4O崘。
在酸性溶液中,鉻酸鹽的氧化性比較明顯,在鹼性溶液中要弱得多:
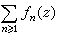
式中E°為標準電極電勢(位)。實際上是重鉻酸鹽起氧化作用,它能氧化硫化氫、碘化氫、亞硫酸、Fe2+ 等。
重要的鉻酸鹽有鉻酸鈉 Na2CrO4和鉻酸鉀K2CrO4,它們都是易溶於水的黃色晶體。20℃時鉻酸鈉的溶解度是76.6克/100克水;鉻酸鉀是62.9克/100克水。鈣、鍶、鋇、汞(Ⅰ)、銀、鉛的鉻酸鹽不溶於水,都能溶於強酸中形成重鉻酸鹽。利用這個特性可鑑定鉻酸根離子。鉻酸鹽可用作氧化劑、油漆顏料和鞣劑等。