過渡金屬催化偶聯反應
過渡金屬催化偶聯反應是指有機金屬試劑與親電有機試劑在第Ⅰ、Ⅱ和Ⅷ副族的過渡金屬催化劑的作用下形成C—C、C—H、C—N、C一()、C—S、C—P或C—M(M指金屬)鍵的反應。作為形成C—C、C—N最為有效的手段之一,過渡金屬催化偶聯反應在有機化學的許多領域都有廣泛套用。
過渡金屬催化偶聯反應通常用發現者人名命名,如Heck反應、Suzuki反應、Sonogashira反應、Stille反應、Glaser偶聯反應、Negishi反應等。
大約100多年前,法國化學家維克多·格林尼(1912年諾貝爾化學獎得主)發現了格氏試劑,其在創造簡單的分子時非常有效。但是,由於格氏試劑反應活性太高,在合成更為複雜的分子時,往往會產生大量的副產物,使反應體系變得複雜;另一方面,這類方法一般難以用來合成兩個不飽和碳之間的C—C鍵(如烯基之間、芳基之間或它們二者之間的C—C鍵)。
因此,自1968開始,隨著金屬有機化學在20世紀70年代的蓬勃發展,赫克等在人們對銅催化Ullmann反應等改進和提高的基礎上,系統地研究了鈀催化交叉偶聯反應。各種鈀等過渡金屬催化的交叉偶聯的出現,為化學家們提供了有效、精準的工具,化學家們能夠研究一種高效合成C—C鍵,特別是兩個不飽和碳之間的C—C鍵的方法,從而使有機合成進入了一個嶄新的時代。
Pd等過渡金屬催化的偶聯反應
Pd等過渡金屬催化的偶聯反應如Sonogashira交叉偶聯反應、Kumada交叉偶聯反應、Suzuki偶聯反應、Hiyama交叉偶聯反應、Negishi交叉偶聯反應、Stifle偶聯反應和Heek反應,在有機合成上有重要套用,這些偶聯反應機理都涉及氧化加成、金屬轉移化和還原消除等步驟。
(1)Sonogashira偶聯反應
Sonogashira反應通常指在鈀/銅混合催化劑的催化下,鹵代芳烴或鹵代烯烴與端基炔烴之間發生的交叉偶聯反應。該反應是製備取代炔烴的很重要的方法。首先催化量的Cu和炔反應生成炔銅,炔銅與Pd(PPh)Cl。發生金屬轉移化反應,再進行還原消除得到Pd(PPh)Cl。然後零價的鈀與RX發生氧化加成,接著與另一當量的炔銅發生金屬轉移化反應,最後再發生還原消除,生成偶聯產物,同時再生成零價鈀,從而完成整個催化循環。此類反應中經常有少量的炔的二聚物生成。胺在反應中起著非常重要的作用,首先胺可以促進炔銅的產生,其次可以吸收反應中產生的鹵化氫。
Sonogashira反應在有機合成中已經得到了廣泛的套用。化學家利用此反應合成了許多構造有趣的化合物。例如利用六溴苯和TMSA的反應可得到一個車輪軸形狀的六炔基苯,如圖1。
(2)Kumada交叉偶聯反應
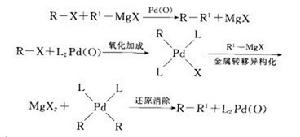 圖2
圖2Kumada交叉偶聯反應(有時也稱Kharasch交叉偶聯反應)是在Ni或Pd催化下,在格氏試劑和一個有機鹵代物或三氟磺酸酯等之間進行的交叉偶聯反應,如圖2。
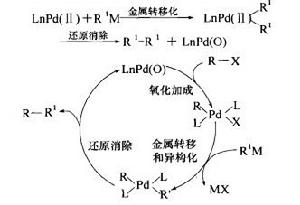 圖3
圖3Kumada交叉偶聯反應和Negishi、Stille、Hiyama及Suzuki等人名反應一樣,都屬於同一類Pd催化的有機鹵代物或有機三氟碘酸酯或其他親電物種與有機金屬試劑之間的交叉偶聯反應。這些反應都有如下所示的催化循環。但Hiyama反應和Suzuki反應稍有不同,有額外的活化步驟來實現金屬轉移作用。 催化循環如圖3。
(3)Suzki偶聯反應
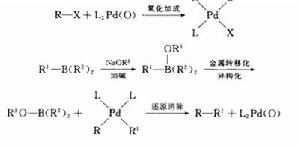 圖4
圖4鈀催化下的有機硼烷和有機鹵、三氟磺酸酯等在鹼存在下發生的交叉偶聯反應(若無鹼的活化作用金屬轉移將受到阻礙)。催化循環見Kumada偶聯反應。反應機理如圖4。
(4)Hiyama交叉偶聯反應
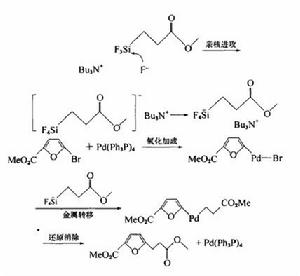 圖5
圖5鈀催化有機矽和有機鹵代物或三氟磺酸酯等在諸如F、OH之類活化劑存在下發生交叉偶聯反應(無活化劑存在時金屬轉移較難進行)。催化循環參見Kumada偶聯。催化循環如圖5。
(5)Negishi交叉偶聯反應
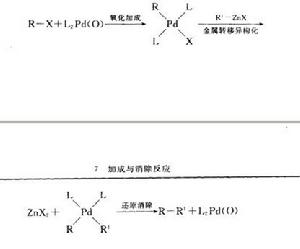 圖6
圖6Pd催化的有機鋅和有機鹵代物,三氟磺酸酯等之間發生的交叉偶聯反應,催化循環可見Kumada偶聯反應。應機理如圖6。
(6)Stille偶聯反應
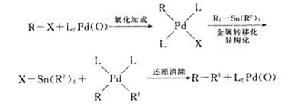 圖7
圖7參見Kumada偶聯反應。Pd催化的有機錫和有機鹵、三氟磺酸酯等之間的交叉偶聯反應。應機理如圖7。
從產物結構類型上看,Suzuki反應與Stille反應很相似。但前者的反應底物為芳香基或烯基硼酸,而且需要加熱條件為180℃(左右),而後者無需加熱,對結構複雜、不耐受熱的產物合成是有利的。
(7)Heck反應
鈀催化的有機鹵代物或三氟磺酸酯和烯烴之間的偶聯反應。應機理如圖8。
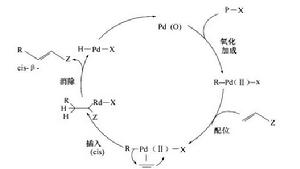 圖8
圖8發生在雜芳基受體上的分子內或分子間的Heck反應,稱為雜芳基Heek反應。應機理如圖9。

