簡介
量熱計測定焓的基本原理是將一定量待測萘樣品在氧彈中完全燃燒,燃燒時放出的熱量使量熱計本身及氧彈周圍介質的溫度升高。通過測定燃燒前後量熱計(包括氧彈周圍介質)溫度的變化值,就可以求出該樣品的燃燒熱(焓)。
實驗測定燃燒焓
實驗目的
1、用氧彈量熱計測定萘的摩爾燃燒焓。
2、了解熱量計中主要部分的作用,掌握氧彈量熱機的實驗技術。
實驗原理
本實驗採用氧彈式量熱機測定萘的燃燒焓,測量的基本原理是將一定量待測萘樣品在氧彈中完全燃燒,燃燒時放出的熱量使量熱計本身及氧彈周圍介質的溫度升高。通過測定燃燒前後量熱計(包括氧彈周圍介質)溫度的變化值,就可以求出該樣品的燃燒熱。實驗測得的是恆容反應熱Q,通過
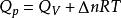 量熱計測定焓
量熱計測定焓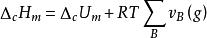 量熱計測定焓
量熱計測定焓即可計算得到萘的摩爾燃燒焓 ΔH。
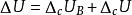 量熱計測定焓
量熱計測定焓整個量熱計可看做一個等容絕熱系統,其熱力學能變ΔU為零。ΔU可表示為+
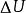 量熱計測定焓
量熱計測定焓=0。
已知m,Q,ΔT,則上式為:m Q +lQ+KΔT=0
實驗測得熱容量K後,根據上式計算Q,進而換算為樣品的摩爾熱力學能變ΔU,再算出樣品的摩爾燃燒焓D H(B ,T)。
本實驗用已知標準摩爾燃燒焓的苯甲酸[ΔH= -3226.71kJ/mol]來測定量熱計的熱容量K,Ql= -6.699J·cm。重複實驗,測定萘的摩爾燃燒焓。
由於量熱計無法做到完全絕熱,因此燃燒前後溫度差的測量值須經雷諾溫度校正圖校正。
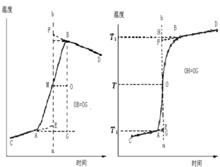 量熱計測定焓
量熱計測定焓實驗儀器、試劑
儀器:氧彈量熱計一台,壓片機一台,萬用表一隻,貝克曼溫度計一支,溫度計(0℃~100℃)一支,點火絲,容量瓶(1000ml)一隻,氧氣鋼瓶及減壓閥一隻
試劑:萘(A.R),苯甲酸(A.R)
實驗裝置
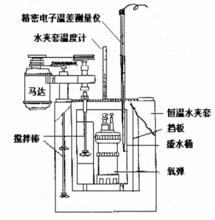 量熱計測定焓
量熱計測定焓實驗步驟
1、熱量容K的測定
⑴準確截取15cm的引燃絲,將引燃絲中部繞成環狀。
⑵稱取苯甲酸0.7763g,在壓片機上壓成片狀。將樣品在桌面上敲擊2~3次,再在分析天平上準確稱量。
⑶擰開氧彈蓋放在專用支架上,將彈內洗淨,擦乾。分別將引燃絲兩端固定在氧彈內兩電極柱上,藥片置於不鏽鋼坩堝中,使引燃絲接觸藥片表面,蓋上氧彈蓋並擰緊。
⑷打開氧氣瓶閥門,調節減壓閥,使壓力達到1~2MPa。將氧彈置於充氧器底座上,使進氣口對準充氧器的出氣口。充氧至充氧器壓力表值約為1.0MPa,用放氣閥將氧彈中的氧氣放出,然後再次充氧約1 MPa,浸入水中檢查是否漏氣,確認密封良好後進行下一步實驗。
⑸將充有氧氣的氧彈放入內桶底座上,檢查攪拌葉片是否正常工作。量取低於室溫的3000ml自來水倒入內桶中,,將貝克曼溫度計的感測器豎直插入量熱計蓋上的孔中,其末端應處於氧彈高度的1/2處。插好點火插頭,裝好攪拌器,打開控制箱的電源開關,按下“攪拌”鍵。攪拌內桶水。儀表開始顯示內桶水溫。
⑹約5min~6min後,系統溫度達到恆定時,開始初期溫度讀數,每隔30s讀數一次。當讀第10次時,將開關旋至點火檔,仍每隔30s讀一次主期溫度讀數,直至兩次溫差小於0.005℃時,再繼續讀溫10次,讀數精確到0.005℃。
⑺停止攪拌,取出溫度計感測器,拔掉引火導線,取出氧彈並擦於其外殼,放掉氧氣,打開氧彈蓋,檢查燃燒是否完全。若內有積碳,則說明此實驗失敗,需重做。若無積碳,則說明實驗成功。取出為燒完的點火絲,測量其長度。
⑻洗淨並擦乾氧彈內外壁,將內桶蒸餾水倒入儲水桶,擦乾全部設備。待氧彈及內桶和攪拌器溫度與室溫平衡後再做下一步實驗。
2、萘的恆熔燃燒熱值測定
稱取0.6945g左右的萘,實驗步驟同上。
數據記錄與處理
室溫: 12.8℃ 大氣壓力:101.54KPa
⑴苯甲酸的實驗數據
樣品質量:0.626g 引燃絲初始長度:13.21cm
剩餘引燃絲長度:3.7cm
⑵萘的實驗數據
樣品質量:0.571g 引燃絲初始長度:12.21cm
剩餘引燃絲長度:3.49cm
苯甲酸燃燒前後所得的一系列水溫和時間關係圖(大致趨勢如下圖)
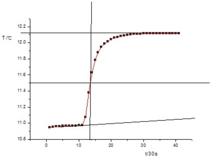 量熱計測定焓
量熱計測定焓萘燃燒前後所得的一系列水溫和時間關係圖(大致趨勢如下圖)
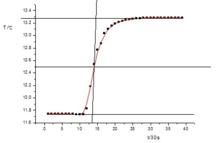 量熱計測定焓
量熱計測定焓最後計算實驗的相對誤差。
結果與討論
1.造成誤差的原因有:
a試劑如果不純,就會影響實驗結果的測定
b在校正雷諾溫度時,看圖讀數會有誤差
c引燃絲不是直的,導致測量長度時讀數會有所偏差
2、用氧彈量熱計測定燃燒焓時,要儘可能在接近絕熱的條件下進行,但我們的實驗中不可能完全接近絕熱。
