簡介
酵母雙雜交系統(Yeast two-hybrid system)的建立是基於對真核生物調控轉錄起始過程的認識。細胞起始基因轉錄需要有反式轉錄激活因子的參與。反式轉錄激活因子,例如酵母轉錄因子 GAL4在結構上是組件式的(modular),往往由兩個或兩個以上結構上可以分開,功能上相互獨立的結構域(domain)構成,其中有DNA結合功能域(DNA binding domain,DNA-BD)和轉錄激活結構域(activation domain,DNA-AD)。這兩個結合域將它們分開時仍分別具有功能,但不能激活轉錄,只有當被分開的兩者通過適當的途徑在空間上較為接近時,才能重新呈現完整的GAL4轉錄因子活性,並可激活上游激活序列(upstream activating sequence,UAS)的下游啟動子,使啟動子下游基因得到轉錄。
雙雜交系統的建立得力於對真核生物調控轉錄起始過程的認識。細胞起始基因轉錄需要有反式轉錄激活因子的參與。80年代的工作表明, 轉錄激活因子在結構上是組件式的(modular), 即這些因子往往由兩個或兩個以上相互獨立的結構域構成,其中有DNA結合結構域(DNA binding domain,簡稱為BD)和轉錄激活結構域(activation domain,簡稱為AD),它們是轉錄激活因子發揮功能所必需的。單獨的BD雖然能和啟動子結合,但是不能激活轉錄。而不同轉錄激活因子的BD和AD形成的雜合蛋白仍然具有正常的激活轉錄的功能。如酵母細胞的Gal4蛋白的BD與大腸桿菌的一個酸性激活結構域B42融合得到的雜合蛋白仍然可結合到Gal4結合位點並激活轉錄。
在酵母雙雜交系統中,“誘餌”蛋白X克隆至DNA-BD載體中,表達DNA-BD/X融合蛋白;待測試蛋白Y克隆至AD載體中,表達AD/Y融合蛋白。一旦X與Y蛋白間有相互作用,則DNA-BD和AD也隨之被牽拉靠近,恢復行使功能,激活報告重組體中LacZ和HIS3基因的表達。
技術步驟
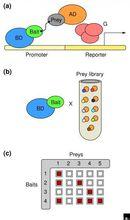 酵母雙雜交系統技術步驟
酵母雙雜交系統技術步驟1.將待測基因與Gal4或LexA或其他合適蛋白的DNA結合域融合構建誘餌質粒;
2.將誘餌質粒轉化缺乏報告基因啟動子的酵母細胞株中,選擇被轉化的酵母;
3.再將文庫質粒轉化到酵母中;
4.通過報告基因的功能篩選相互作用的蛋白。
研究過程
Fields等人的工作標誌雙雜交系統的正式建立。他們以與調控SUC2基因有關的兩個蛋白質Snf1和Snf2為模型,將前者與Gal4的BD結構域融合,另外一個與Gal4的AD結構域的酸性區域融合由BD和AD形成的融合蛋白一般分別稱之為“誘餌”(bait)和“獵物”或靶蛋白(prey or target protein)。如果在Snf1和Snf2之間存在相互作用,那么分別位於這兩個融合蛋白上的BD和AD就能重新形成有活性的轉錄激活因子,從而激活相應基因的轉錄與表達。這個被激活的、能顯示“誘餌”和“獵物”相互作用的基因稱之為報告基因(reporter gene)。通過對報告基因表達產物的檢測,反過來可判別作為“誘餌”和“獵物”的兩個蛋白質之間是否存在相互作用。在此Fields等人採用編碼β-半乳糖苷酶的LacZ作為報導基因,並且在該基因的上游調控區引入受Gal4蛋白調控的GAL1序列。這個改造過的LacZ基因被整合到酵母染色體URA3位上。而酵母的GAL4基因和GAL80基因(Gal80是Gal4的負調控因子)被缺失,從而排除了細胞內源調控因子的影響。已經知道在Snf1和Snf2之間存在相互作用。結果發現只有同時轉化了Snf1和Snf2融合表達載體的酵母細胞才有β-半乳糖苷酶活性,單獨轉化其中任何一個載體都不能檢測出β-半乳糖苷酶活性。
發展
發展起來的各種雙雜交系統大多是以Fields等人建立的系統為基礎的。這些新系統主要對報導基因、“誘餌”表達載體以及“獵物”表達載體等做了一些改進。其中一個重要改進是引入額外的報導基因,如廣泛採用的HIS3基因。經過改造帶有HIS3報導基因的酵母細胞,只有當HIS3被啟動表達才能在缺乏組氨酸的選擇性培養基上生長。HIS3報導基因的轉錄表達是由“誘餌”和“獵物”的相互作用所啟動的。大多數雙雜交系統往往同時使用兩個甚至三個報導基因,其中之一是 LacZ。這些改造後的基因在啟動子區有相同的轉錄激活因子結合位點,因此可以被相同的轉錄激活因子(如上述的Gal4蛋白)激活。通過這種雙重或多重選擇既提高了檢測靈敏度又減少了假陽性現象。其他還有針對“誘餌”或“獵物”表達載體等所作的改進,這裡不一一詳述。
在雙雜交鑑定過程中要經過兩次轉化,這個工作量是相當大的,特別是尋找新的作用蛋白質的時候尤其如此。而且,酵母細胞的轉化效率比細菌要低約4個數量級。因此轉化步驟就成為雙雜交技術的瓶頸。Bendixen等人通過酵母接合型的引用,避免了兩次轉化操作,同時又提高了雙雜交的效率。在酵母的有性生殖過程中涉及到兩種配合類型:a接合型和α接合型,這兩種單倍體之間接合(mating)能形成二倍體,但a接合型細胞之間或α接合型細胞之間不能接合形成二倍體。根據酵母有性生殖的這一特點,他們將文庫質粒轉化α接合型酵母細胞,“誘餌”表達載體轉化a接合型細胞。然後分別鋪篩選平板使細胞長成菌苔(lawn),再將兩種菌苔複印到同一個三重篩選平板上,原則上只有誘餌和靶蛋白發生了相互作用的二倍體細胞才能在此平板上生長。單倍體細胞或雖然是二倍體細胞但BD融合蛋白和AD融合蛋白不相互作用的都被淘汰。長出來的克隆進一步通過β-半乳糖苷酶活力進行鑑定。這項改進不僅簡化了實驗操作,而且也提高了雙雜交的篩選效率。
套用
酵母雙雜交系統能在體內測定蛋白質的結合作用,具有高度敏感性。
主要是由於:
①採用高拷貝和強啟動子的表達載體使雜合蛋白過量表達。
②信號測定是在自然平衡濃度條件下進行, 而如免疫共沉澱等物理方法為達到此條件需進行多次洗滌,降低了信號強度。
③雜交蛋白間穩定度可被激活結構域和結合結構域結合形成轉錄起始複合物而增強,後者又與啟動子DNA結合, 此三元複合體使其中各組分的結合趨於穩定。
④通過mRNA產生多種穩定的酶使信號放大。同時, 酵母表型, X-Gal及HIS3蛋白表達等檢測方法均很敏感。
逆雙雜交系統
在研究蛋白質的結構功能特點、作用方式過程中,有時還要通過突變、加抑制劑等手段破壞蛋白質間的相互作用。針對實際工作中的這種需要,Vidal等人發展了所謂的逆雙雜交系統(reverse two-hybrid system)。這項技術的關鍵是報導基因URA3的引入。URA3基因在這裡起到了反選擇的作用,它編碼的酶是尿嘧啶合成的關鍵酶。該酶能把5-氟乳清酸(5-FOA)轉化成對細胞有毒的物質。Vidal等人通過改造在URA3基因的啟動子內引入Gal4的結合位點。這個改造的酵母菌株在缺乏尿嘧啶的選擇性培養基上只有當“誘餌”和“獵物”相互作用激活URA3基因的表達才能生長。在含有5-FOA的完全培養基上“誘餌”和“獵物”的相互作用則抑制細胞的生長。然而如果目的蛋白,即與DB或AD融合的蛋白質發生了突變或者由於外加藥物的干擾不再相互作用,URA3基因不表達,則細胞能在含有5-FOA的完全培養基上生長。通過這種方法,Vidal等人篩選到了轉錄因子E2F1的突變物,這些突變物仍然能結合視網膜母細胞瘤蛋白RB,但是喪失了同另外一種稱為DP1蛋白的結合能力。結果得到了體外結合實驗的驗證。通過對這些突變蛋白基因的測序,他們發現了新的E2F1同DP1結合的位點。

