詞義
酯化反應為可逆反應,在酯的溶液中,是有少量的游離醇和酸存在的。酯交換反應正是基於酯化反應的可逆性而進行的。酯交換反應中的醇能夠與酯溶液中少量游離的酸進行酯化反應,新的酯化反應就生成了新的酯和新的醇。由於酯化反應的可逆性,若想酯交換反應能夠進行,至少滿足下面兩種情況的一種:一,生成的新酯穩定性強於之前的酯。二,生成的新酯能夠在反應過程中不斷蒸出。反應機理
脂肪酸甲酯主要是由甘油三酯與甲醇通過酯交換製備,其反應方程式如下: 油脂(甘油三酯)先與一個甲醇反應生成甘油二酯和甲酯,甘油二酯和甲醇繼續反應生成甘油單酯和甲酯,甘油單酯和甲醇反應最後生成甘油和甲酯。酯交換催化劑包括鹼性催化劑、酸性催化劑、生物酶催化劑等。其中,鹼性催化劑包括易溶於醇的催化劑(如NaOH、KOH、NaOCH3、有機鹼等)和各種固體鹼催化劑;酸性催化劑包括易溶於醇的催化劑(如硫酸、磺酸等)和各種固體酸催化劑。催化劑
鹼性催化劑
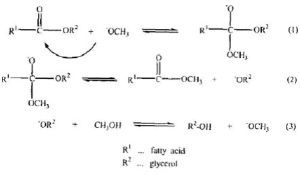
 酯交換反應
酯交換反應 甲氧陰離子攻擊甘油三酯的羰基碳原子,形成一個四面體結構的中間體,然後這箇中間體分解成一個脂肪酸甲酯和一個甘油二酯陰離子,這個陰離子與甲醇反應生成一個甲氧陰離子和一個甘油二酯分子,後者會進一步轉化成甘油單酯,然後轉化成甘油。所生成的甲氧陰離子又循環進行下一個的催化反應。
鹼性催化劑是目前酯交換反應使用最廣泛的催化劑。使用鹼性催化劑的優點是反應條件溫和、反應速度快。有學者估計,使用鹼催化劑的酯交換反應速度是使用同當量酸催化劑的4000倍。鹼催化的酯交換反應甲醇用量遠比酸催化的低,因此工業反應器可以大大縮小。另外,鹼性催化劑的腐蝕性比酸性催化劑弱很多,在工業上可以用價廉的碳鋼反應器。除了上述優點外,使用鹼性催化劑還有以下缺點:鹼性催化劑對游離脂肪酸比較敏感,因此油脂原料的酸值要求比較高。對於高酸值的原料,比如一些廢棄油脂,需要經過脫酸或預酯化後才能進行鹼催化的酯交換反應。
工業化鹼性催化劑
已經工業化的鹼性催化劑主要有兩類:易溶於甲醇的KOH、NaOH、NaOCH3等催化的液相反應,以及固體鹼催化的多相反應。絕大多數的生物柴油工業生產裝置都採用液相催化劑,用量為油重的0.5~2.0%。甲醇鈉與氫氧化鈉(或鉀)用作酯交換催化劑時還有所不同。當使用甲醇鈉為催化劑時,原料必須經嚴格精製,少量的游離水或脂肪酸都影響甲醇鈉的催化活性,國外工藝中要求兩者的含量都不超過0.1%;但其產物中皂的含量很少,有利於甘油的沉降分離及提高生物柴油收率。而氫氧化鈉(或鉀)為催化劑對原料的要求相對不嚴格,原料中可含少量的水和游離脂肪酸,但這會導致生成較多的脂肪皂,影響甘油的沉降分離速度,同時會導致甘油相中溶解較多的甲酯,從而降低生物柴油的收率。一般說來,以氫氧化鈉(或鉀)為催化劑,油脂原料的酸值不要超過2mgKOH/g,催化劑的用量為油脂重量的0.5~2.0%。即使油脂原料的酸值較高,超過2mgKOH/g,理論上還可以使用氫氧化鈉(或鉀)催化劑,但需要加入過量的催化劑以中和游離脂肪酸。這種條件下皂的生成量高,甘油沉降分離困難,且甘油相中溶解的甲酯量較高,因此不宜採取。對於氫氧化鈉和氫氧化鉀,當用作酯交換催化劑時也有所不同。(1)在對粗產物進行沉降分離過程中,催化劑主要存在於甘油相中。由於KOH的分子量大於NaOH,因此會提高甘油相的密度,加速甘油相的沉降分離。(2)使用KOH為催化劑皂的生成量要比使用NaOH時少,這會減少甲酯在甘油相中的溶解。國外一項研究表明,以KOH為催化劑催化葵花籽油酯交換,分離後的甘油相中,甲酯的摩爾含量為3%,而以NaOH為催化劑時的摩爾含量為6%。(3)以KOH為催化劑,產物用磷酸中和可生成磷酸二氫鉀,這是一種優質肥料,不僅可以減少廢物的排放,同時還會增加經濟效益。與其相比,鈉鹽只能作為廢物處理。NaOH為催化劑的優點是其價格便宜。除此之外,國內外還在開發有機鹼催化劑,比如胺類等。當以有機胺為催化劑時,在常壓低溫下經過6~10h的反應,可以達到比較高的轉化率,但產物中甘油單酯和二酯的含量很高,而甘油的量很低,難以工業套用;當提高反應壓力和溫度時,反應過程中又有可能生成醯胺,降低產品質量。因此,以有機鹼為酯交換催化劑還需要有做大量的研究工作來證明其可行性。固體鹼催化劑最近幾年正在工業化。與液鹼催化劑相比,使用固體催化劑可以大大提高甘油相的純度,降低甘油精製的成本,“三廢”排放少,產物不含皂,提高生物柴油收率;但反應速度慢,需要較高的溫度和壓力,較高的醇油比,且對游離脂肪酸和水比較敏感,原料需嚴格精製。法國石油研究院開發的Esterfip-H工藝是第一個將固體鹼為催化劑成功套用於工業生成的生物柴油生成工藝,其催化劑是具有尖晶石結構的雙金屬氧化物,已經建成16萬噸/年的生成裝置。另外,德國波鴻的魯爾大學也開發了一種固體鹼催化劑,這種固體鹼催化劑是一種胺基酸的金屬絡合物,催化酯交換反應的溫度為125℃,高於液鹼催化劑的反應溫度(60℃左右)。將建設1噸/小時的工業示範裝置。日本正在開發強鹼性陰離子樹脂催化劑,已取得很大進展。不過陰離子樹脂只能在低溫(60℃以下)操作,否則很快失活,而低溫下酯交換活性又比較低,所以限制了其工業套用。由於樹脂容易再生,因此若將來能開發出耐高溫的強鹼性樹脂,則具有一定的工業化前景。除此之外,國內外正在開發的固體鹼催化劑還包括粘土、分子篩、複合氧化物、碳酸鹽以及負載型鹼(土)金屬氧化物等。酸性催化劑
酸催化酯交換的反應機理如下圖所示。質子先與甘油三酯的羰基結合,形成碳陽離子中間體。親質子的甲醇與碳陽離子結合併形成四面體結構的中間體,然後這箇中間體分解成甲酯和甘油二酯,並產生質子催化下一輪反應。甘油二酯及甘油單酯也按這個過程反應。與鹼催化相比,酸性催化劑可以加工高酸值原料,因為在酸性催化劑存在下,游離脂肪酸會與甲醇發生酯化反應生成甲酯。因此酸性催化劑非常適合加工高酸值的油脂。另外,對於長鏈或含有支鏈的脂肪醇與油脂的酯交換,一般也用酸性催化劑。但是,酸催化酯交換的反應速度非常慢,且需要比較高的反應溫度和醇油比。在酸催化反應中,如反應溫度較高,可能副反應,生成副產物如二甲醚、甘油醚等。另外,在酸催化中,水對催化劑活性的影響非常大。據報導,硫酸催化大豆油與甲醇酯交換的反應中,若大豆油中加入0.5%的水,則酯交換轉化率由95%降到90%。如果加入5%的水,則轉化率僅為5.6%。在酯交換過程中生成的碳陽離子容易與水反應生成碳酸,從而降低生物柴油收率。當油脂中游離脂肪酸含量高時應注意這一問題,因為酸性催化劑會催化游離脂肪酸與甲醇酯化,從而產生一定量的水,影響反應進程,一步酯交換反應難以達到滿意的轉化率。以高酸值的油脂如廢棄油脂為原料時,為了避免產生的水的影響,工業上常常採用邊反應邊脫水的方法,或採用間歇操作,把水分出去後再補充甲醇繼續反應。
在工業套用中,最常用的酸性催化劑是濃硫酸和磺酸或其混合物。兩者相比,硫酸價格便宜,吸水性強,這有利於脫除酯化反應生成的水,缺點是腐蝕性強,且較容易與碳碳雙鍵反應,導致產物的顏色較深。磺酸催化劑的催化活性比硫酸弱,但在生成過程中產生的問題少,且不攻擊碳碳雙鍵。
強酸型陽離子交換樹脂和磷酸鹽是兩種典型的酯交換酸性固體酸催化劑,但它們都需要比較高的反應溫度和較長的反應時間,且酯交換的轉化率比較低,使用說明短,因此限制了工業套用。其它固體酸催化劑如硫酸鋯、硫酸錫、氧化鋯及鎢酸鋯等也有人在研究。
另外,據2005年11月的Nature報導,日本東京工業大學正在開發從天然有機物如糖、澱粉、纖維素等生產固體酸催化劑。其製備方法是先把有機物如葡萄糖、蔗糖在低溫(>300℃)下進行不完全碳化,然後進行磺化反應,引進磺酸基,得到磺化的非定形碳催化劑。此種催化劑具有價格便宜、酯化活性高、使用壽命長的特點,但還沒發現用於酯交換反應方面的報導。
在國外的生物柴油生成裝置中,很少用酸催化的酯交換工藝。酸性催化劑主要被用來對酸值較高的油脂進行預酯化,然後再進行鹼催化的酯交換。我國現有的生物柴油廠主要以高酸值的廢棄油脂為原料,規模小,使用的催化劑大多是液體酸,也有少數開發使用固體酸。使用固體酸催化劑對高酸值的植物油進行預酯化,然後再用鹼催化酯交換製備生物柴油,是一條較好的工藝路線。
實驗
本文著重研究酯交換反應的反應條件。a.先將菜油用無水氯化鈣進行乾燥,同時減壓脫水;b.按n(醇):n(油)=5~7:1的配比,放入反應裝置,然後加入菜油質量2%~4%經煅燒處理過的LDH/LDO催化劑;c.反應溫度控制在60~70℃之間,攪拌回流3h;d.反應結束後,進行常壓蒸餾,回收過量的醇;℃.用布氏漏斗過濾回收催化劑,濾液放入梨形分液漏斗中靜置分層,下層為甘油,上層為產物,別稱重;
f.計算出酯交換深度、產率和轉化率。
2結果與討論
2.1酯交換工藝參數的確定
通過正交試驗得出酯交換最佳反應條件為:菜油與甲醇的物質的量比為1B6,催化劑用量(按菜油質量計)2%,反應時間3h,反應溫度為甲醇沸點
在此條件下進行重複試驗,產率和轉化率都同時達到98%以上。
2.2影響因素的討論
2.2.1醇油物質的量比
醇油物質的量比是影響酯交換轉化率的主要因素之一。根據計算,完全酯交換1mol甘油三酯需mol醇,生成3mol脂肪酸酯和1mol甘油。如果n(醇)Bn(油)過大,會嚴重影響甘油的重度分離增加分離費用,同時也不能提高轉化率,只能增加醇的回收費用。所以,為了使反應最經濟,結果最佳且反應混合物後處理較容易,甲(乙)醇與菜油的物質的量比為6B1為最佳。對於部分酯交換,甲醇加入量對最終產品改性菜油性能有很大的影響,加入量少酯交換深度低)OH引入少,產品水溶性差;加入量多酯交換深度高,產品乳化性能差。
2.2.2催化劑用量
在酯交換反應過程中,如果不加入催化劑,或加入很少量催化劑,即使甲醇過量很多,它和菜油的反應也是極為緩慢的,隨著催化劑用量的增加,酯交換反應速度相應加快。因此,催化劑加入量不足則反應時間較長或轉化率不高;但催化劑加入量過多,過多的鹼性中心會引起皂化反應,導致產品乳化不易分離,後處理複雜,同時影響產率和轉化率。從正交試驗可以看出,菜油與甲醇反應時,催化劑LDHLDO為菜油質量的2%為宜。
2.2.3反應溫度
溫度對酯交換反應的轉化率影響較大,溫度低轉化率低,同時酯交換速率低,反應時間延長,所以本實驗反應溫度控制在醇的沸點下進行,保持體系在微沸狀態下。低於此值反應速度緩慢,高於此值醇易揮發損失,這2種情形均不利於酯交換反應的正常進行。
2.2.4反應時間
不同的油脂進行酯交換反應的難易程度不竟相同,例如,豆油用甲醇酯交換的反應時間短至0.1h,60℃和45℃收率高達97%~98%,反應溫度控制在30℃時同樣的收率酯交換反應時間需4h。不同的催化劑對反應時間也有影響。用氫氧化鈉作催化劑,進行菜油酯交換,反應時間只需2h。本文中採用LDH/LDO固體鹼作催化劑,反應時間有所延長,主要因為非均相催化反應,活性中心和反應物需要相接觸的時間。
2.2.5菜油中的水分和游離酸水、CO2和酸是催化劑LDH/LDO的毒物。因
此在酯交換反應過程中,原料應儘量符合無水、無游離酸的要求,以免催化劑中毒,導致催化劑耗量增多。Wright等人曾經報導原料要求游離脂肪酸<
0.5%,酸值<2。在試驗過程中,有時會出現催化劑結成大顆粒、產品乳化難分離現象,可能是由於菜油乾燥不充分、外界空氣中潮濕水分、CO2導致催化劑活性減低。所以在實驗前原料應充分乾燥,催化劑需通過煅燒處理。
3酯交換反應動力學的探討
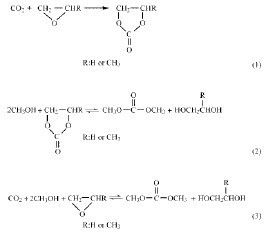
油脂的酯交換可在酸或鹼催化下進行,但使用酸比鹼反應要慢且易腐蝕設備,當油脂中游離酸含量低時,一般選用鹼催化劑。1986年,Fr℃℃dman發表了油脂酯交換的動力學研究報告,指出酯交換是一種鏈反應和可逆反應。植物油的酯交換反應可描述如下:
4結論
1固體鹼LDH/LDO在酯交換反應中具有較高的活性,產率、轉化率達98.5%以上。該工藝操作簡單,可直接獲得脂肪酸甲酯,甘油雙、單酯和副產物
甘油,無需精製處理,催化劑可回收再生,整個過程無三廢污染,工業化前景廣闊。
2菜油與甲醇完全酯交換的最佳反應條件為:反應溫度為65~70℃,反應時間為3h,醇油物質的量比為6B1,催化劑用量為菜油質量的2%。
3酯交換反應對皮革加脂劑的合成開發具有重要意義,可以拓寬原料來源,開發出性能優良的加脂劑。