定義
配離子的電荷數等於中心原子和配體總電荷的代數和。
舉例
 配離子的電荷
配離子的電荷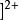 配離子的電荷
配離子的電荷 配離子的電荷
配離子的電荷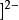 配離子的電荷
配離子的電荷例如,在Cu(NH)中,NH是中性分子,所以配離子的電荷就等於中心原子的電荷數+2。 而在HgI中,配離子的電荷數=1 x ( +2) + 4 x ( -1)= - 2 。
套用
由於配合物是電中性的,因此,外界離子的電荷總數和配離子的電荷總數相等,而符號相反,所以由外界離子的電荷可以推斷出配離子的電荷及中心原子的氧化值。例如,K[Fe(CN)]中 ,外界離子的電荷總數=4x(+1)= + 4,所以其配離子的電荷為 - 4 ,可以推出中心原子鐵的氧化值為Fe(II)。
知識拓展
配合物的定義
為了說明什麼是配合物,我們先看一下向硫酸銅溶液中滴加過量氨水的實驗。 在盛有硫酸銅溶液的試管中滴加氨水,邊加邊搖,開始時有大量天藍色的沉澱生成, 繼續滴加氨水時,沉澱逐漸消失,得深藍色透明溶液。 若向這種深藍色溶液中加入NaOH溶液,無天藍色氫氧化銅沉澱生成,但若向該溶液中加入少量氯化鋇溶液時,則有白色硫酸鋇沉澱析出。這說明溶液中存在著硫酸根離子, 卻幾乎檢査不出銅離子。
 配離子的電荷
配離子的電荷 配離子的電荷
配離子的電荷往深藍色溶液中加入乙醇,立即有深藍色晶體析出。經 X 射線分析,該深藍色結晶的化學組成是[Cu(NH)]S0 ·H0。它在水溶液中能夠完全解離為Cu(NH)和硫酸根離子 ,而前者是由1個銅離子和4個氨分子相互結合形成的複雜離子。這類複雜的離子稱為配位個體。
通常把具有空軌道的中心原子或陽離子與可以提供孤電子對的配位體(可能是陰離子或中性分子)以配位鍵形成的不易解離的複雜離子(或分子)稱為配位個體。配位個體可以是中性分子,也可以是帶電荷的離子。不帶電荷的中性配位個體也稱配位分子,它本身就是配合物。帶電荷的配位個體稱為配離子,其中帶正電荷的配位個體稱為配陽離子;帶負電荷的配離子稱為配陰離子。
由帶電荷的配位個體所形成的相應化合物及中性配位個體統稱為配合物(習慣上把帶電荷的配位個體也稱為配合物)。如[Cu(NH)]S0是配合物。
配合物的組成
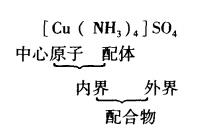 配離子的電荷
配離子的電荷配合物由內界和外界兩部分組成。內界為配合物的特徵部分(即配位個體),是一個在溶液中相當穩定的整體,在配合物的化學式中以方括弧標明。方括弧以外的離子構成配合物的外界,內界與外界之間以離子鍵結合。內界與外界離子所帶電荷的總量相等,符 號相反。顯然,中性配位個體只有內界,沒有外界。以[Cu(NH)]S0為例,其組成可表示為

