簡介
親電反應 electrophilic reaction
親電反應指缺電子(對電子有親和力)的試劑進攻另一化合物電子云密度較高(富電子)區域引起的反應。親電反應屬於離子型反應(ionic reaction)的一種,是有機化學的基本反應之一。
在相互作用的兩個體系之間,由於一個體系對另一個體系的電子的吸引所引起的化學反應。這些反應屬於離子反應。反應試劑在反應過程中,從與之相互作用的原子或體系得到或共享電子對者,稱為親電試劑(E+)。
凡由親電試劑如HNO3、H2SO4、Cl2、Br2等與有機分子相互作用而發生的取代反應,稱為親電取代反應(SE):
E++RX─→RE+X+
式中R為烷基。上述類型的正離子取代反應屬於SE類型反應。例如,CH3:MgBr與溴反應時,溴分子的正電荷部分(相當於上式中的E+)與帶著一對電子的甲基反應:
CH3:|MgBr+Br+|:Br-─→CH3Br+MgBr2
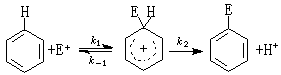
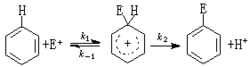 親電反應
親電反應在芳香族化合物親電取代反應中,親電試劑進攻芳香環,生成σ絡合物,然後離去基團變成正離子離開,離去基團在多數情況下為質子:
一般,第二步的速率比第一步高(k2》k1,k)。
由親電試劑進攻所引起的加成反應稱為親電加成反應。在沒有光照和自由基引發的條件下,烯烴與鹵素的加成反應是親電加成反應,例如:
CH3CH=CH2+Br2─→CH3CHBrCH2Br
反應在非極性溶劑中進行時,極性物質如極性容器壁,極性的溶質如氯化氫、水等都具有催化作用,使反應速率加快。加成速率與烯烴的結構密切相關,雙鍵連有給電子基團者加溴就快,連有吸電子基團者加溴就慢。
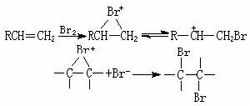 親電反應
親電反應在大多數情況下,親電加成反應是反式加成,加成中間體為溴橋正離子,反應是分步進行的:
反應物
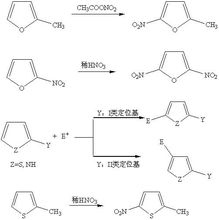 親電反應
親電反應在親電反應過程中,從與之相互作用的原子或體系得到或共享電子對的反應物,稱為親電試劑(electrophiles E);與親電試劑作用的反應物稱為親核試劑(nucleophile Nu)。最常見的親電試劑是鹵代烴(halohydrocarbon)和醯鹵(acyl halide),親電試劑是路易斯酸(Lewis acid),因而親電試劑的親電性與其酸性有關,一般而言,酸性強的親電試劑親電性強,但二者沒有定量關係,特例也有不少。
機理
親電反應在機理上可分為三類,有所不同,故請參閱對應條目
·親電加成反應(electrophilic addition )
·親電取代反應(electrophilic substitution)
·親電重排反應(electrophilic rearrangement)
相關
·周環反應(pericyclic reaction)
·親核反應(nucleophilic reaction)
·游離基反應(free radical reaction)