定義
使液體表面積增大的過程是克服液相分子吸引力, 使體相分子轉移到表面相的過程,需要環境對體系做功。以可逆方式做功最少,稱之為表面功。
增大液膜面積dA,需抵抗力F,作非體積功——表面功。可逆條件下,忽略摩擦力,則為可逆表面功。
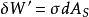 表面功
表面功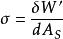 表面功
表面功其中, 。
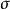 表面功
表面功的意義:使液體增加單位表面積時,環境所需作的可逆功→表面功。單位J·m 。
舉例來說,表面功是由凝聚態物體的表面積改變所做的功。
例如水滴長大要對抗其表面張力σ而做功。要使表面積增加dS,則此時的表面功為W表面=σdS或W表面=∫σdS。
在熱力學中常規定體系對外界做功,功取負值,外界對體系做功,功取正值。
 表面功
表面功表面函式
恆溫恆壓下:
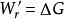 表面功
表面功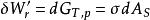 表面功
表面功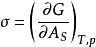 表面功
表面功σ=系統增加單位面積時所增加的G →(比)表面Gibbs函式,J·m 。
表面張力
舉例
用肥皂液在一個系有線圈的金屬環上形成一個液膜,由於線圈周圍都是相同的液體,受力均衡,線圈可以在液膜上自由移動位置。
 表面功
表面功若將線圈內液膜刺破,線圈兩邊受力不再平衡,立即繃緊成圓形。
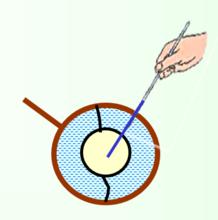 表面功
表面功這些現象表明,在液體表面存在一種使液面收縮的力,稱表面張力(surface tension)或界面張力(interfacial tension)。
表面張力的方向和表面相切,是垂直作用在表面上單位長度線段上的表面收縮力。
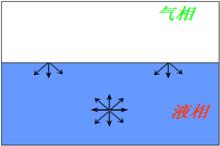
表面層分子受力 表面層分子與體相內分子所處的力場不同。主要受到指向液體內部的拉力,使表面層液體分子有向液體內遷移、力圖縮小表面積的趨勢。液滴→球形。若擴大表面積,對系統作功。
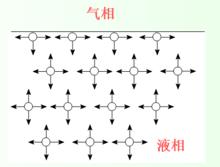 液體表面與內部分子受力情況
液體表面與內部分子受力情況物理意義
表面張力,單位面積的表面功,單位面積的表面Gibbs函式,不同物理量有相同的數值和量綱。
因為1 J =1 N·m→1 J·m =1 N·m 其它界面有界面張力。
相關關係
與吉布斯自由能的關係
由吉布斯自由能性質可知,在恆溫恆壓下,此表面功即等於體系吉布斯自由能的變化量的相反數:
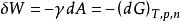 表面功
表面功此式表明,考慮表面相貢獻的多相體系,除了溫度、壓力、組成等因素,表面積也是影響體系熱力學函式的一個重要變數。
