定義
蛋白質膠體是指蛋白質在水中形成的一種比較穩定的親水膠體。蛋白質是高分子有機化合物,其分子直徑在2~20nm,在溶液中易形成大小介於1~100nm的質點(膠體質點的範圍),因此,蛋白質具有布朗運動、光散射現象、不能透過半透膜以及具有吸附能力等膠體的一般性質。蛋白質溶液屬於膠體系統,在水中形成一種比較穩定的親水膠體。
穩定因素
 蛋白質膠體
蛋白質膠體蛋白質溶液膠體系統的穩定性依賴於以下兩個基本因素:
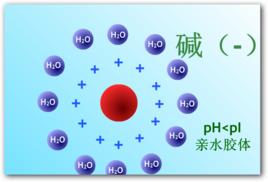
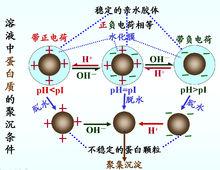
(1)蛋白質表面形成水化層 由於蛋白質顆粒表面帶有許多如一NH ;、一COO 、一OH、一SH、一CO一NH,肽鍵等親水的極性基團,因而易於發生水合作用(hydration),進而使蛋白質顆粒表面形成一層較厚的水化層。水化層的存在使蛋白質顆粒相互隔開,使蛋白質顆粒不致聚集而沉澱。每1g蛋白質結合水0.3~0.5g。
(2)蛋白質表面具有同性電荷 蛋白質溶液除在等電點時分子的淨電荷為零外,在非等電點狀態時,蛋白質顆粒皆帶有同性電荷,即在酸性溶液中帶正電荷,在鹼性溶液中帶負電荷,與其周圍的反離子構成穩定的雙電層。蛋白質膠體分子間表面雙電層的同性電荷相互排斥,進而阻止其聚集而沉澱。
破壞穩定性方法
根據蛋白質膠體穩定性原理,可以通過破壞這兩個主要穩定因素,使蛋白質分子間的引力增加聚集沉澱。如鹽析法、有機溶劑沉澱法。
如果加人適當的試劑使蛋白質分子處於等電點狀態或失去水化層,蛋白質的膠體溶液就不再穩定並將產生沉澱。蛋白質溶液可因下列試劑的加入而發生蛋白質沉澱。
高濃度中性鹽
 蛋白質膠體
蛋白質膠體加入高濃度的硫酸銨、硫酸鈉、氯化鈉等,可有效地破壞蛋白質顆粒的水化層,同時又中和了蛋白質的電荷,從而使蛋白質生成沉澱。這種加入中性鹽使蛋白質沉澱析出的現象稱為鹽析,常用於蛋白質的分離製備。不同蛋白質析出時需要的鹽濃度不同,調節鹽濃度以使混合蛋白質溶液中的幾種蛋白質分段析出,這種方法稱為分段鹽析。例如,血清中加入硫酸銨至50%飽和度時,球蛋白即可析出;繼續加硫酸銨至飽和,清蛋白才能沉澱析出。球蛋白通常不溶於純水,而溶於稀中性鹽溶液,其溶解度隨稀鹽溶液濃度的增加而增大,表現鹽溶特性。
有機溶劑
丙酮、乙醇等有機溶劑有較強的親水能力,一般作為脫水劑,也能破壞蛋白質分子周圍的水化層,導致蛋白質沉澱析出;如將溶液的pH調至蛋白質的等電點,再加入這些有機溶劑可加速沉澱反應。
重金屬鹽
Hg 、Ag 、Pb 等重金屬離子可與蛋白質中帶負電荷的基團形成不易溶解的鹽而沉澱,因此重金屬鹽均有毒,誤食重金屬鹽時應及時服用大量生蛋清或牛乳,可防止這些有害離子被吸收。
生物鹼和某些酸類
如苦味酸、三氯乙酸、鉬酸、鎢酸、磷鎢酸、單寧酸等生物鹼試劑,可與蛋白質中帶正電荷的基團生成不溶性的鹽而析出。用鹽析法或在低溫下加入有機溶劑(先將蛋白質用酸鹼調節到等電點狀態)製取的蛋白質,仍保持天然蛋白質的一切特性和原有的生物活性,透析或超濾除去中性鹽和有機溶劑,蛋白質仍可溶於水形成穩定的膠體溶液。若製備時溫度較高或未能及時除去有機溶劑,析出的蛋白質可部分或全部失活。
意義
蛋白質的親水膠體性質具有重要的生理意義。生物體中最多的成分是水,蛋白質與大量的水結合可形成各種流動性不同的膠體系統。如構成生物細胞的原生質就是複雜的、非均一性的膠體系統,生命活動的許多代謝反應即在此系統中進行。其他各種組織細胞的形狀、彈性、黏度等性質,也與蛋白質的親水膠體性質密切相關。
蛋白質的膠體性質還是許多蛋白質分離、純化的基礎。如蛋白質鹽析、等電點沉澱和有機溶劑分離沉澱法的基本原理就是破壞了蛋白質分子表面的水化層和同性電荷作用的穩定因素,進而使蛋白質顆粒相互聚集而沉澱,其他透析法是利用蛋白質大分子不能透過半透膜的性質以除去無機鹽等小分子雜質。