蛋白
 膜融合
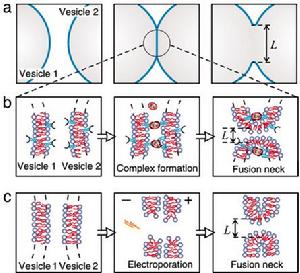
膜融合某些病毒囊膜蛋白在較低pH值時,具有催化膜融合的功能。病毒通過受體介導的內吞作用進入被其感染的細胞,被運送到胞內體,在胞內體酸性條件激活下,病毒囊膜融合蛋白催化病毒與胞內體膜融合,使病毒核酸進入胞質並進行複製。人們已克隆出多種具有融合作用的病毒融合蛋白的基因,並進一步證明用這類基因轉染的真核細胞表面存在表達的病毒囊膜融合蛋白。當降低細胞培養液的pH值時,被轉染的細胞很快融合形成巨大的多核細胞。近來,哺乳動物細胞的融合蛋白也已被鑑定,與病毒融合蛋白相似,在受精過程中,被認為具有催化精子和卵細胞質膜融合的作用。
啟動步驟
 膜融合
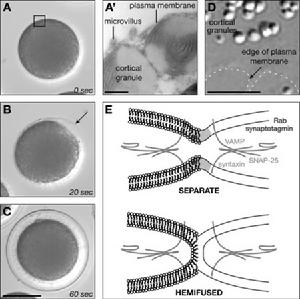
膜融合這次由布朗大學生物學家GaryWessel博士所領導的研究小組,就嘗試著利用海膽(urchin)的卵子(eggs)細胞,來分析膜融合的瞬間,據了解Wessel博士所領導的研究團隊,長期以來就卵子受精的過程,來分析胞膜融合的過程,就先前該團隊的研究資料發現,卵子受精發生膜融合的過程,幾乎只有百萬分之一秒,精子細胞進入卵子細胞後,原本卵細胞膜上成百上千個胞膜所形成的囊泡,會瞬間的釋放出內含物,科學家懷疑這瞬間進行胞膜融合的過程,必然受到了特定蛋白訊號的調控。
結果研究人員利用到螢光染劑,搭配著高解析度的顯微鏡,發現這些胞膜融合過程中,存在著半融合(hemifusion)的啟動階段,而這個階段可長可短,短可以只有隻有幾小時,長則可達數月之久,不過它卻是任何膜融合過程的起點。
研究人員把這個發現,發表在最新一期發育細胞(DevelopmentalCell)期刊上,並表示下一個階段的研究,就是如何的把這一個發現,套用到藥物的輸送上。

