成份
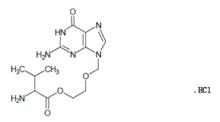 維德思
維德思化學名稱:L-纈氨酸-2-[(6-氧代-2-氨基-1,6-二氫-9H-嘌呤-9-基)甲氧基]乙基酯鹽酸鹽。
化學結構式:
分子式:CHNO•HCl
分子量:360.8
性狀
本品為薄膜衣片,除去薄膜衣後顯白色至類白色。
適應症
本品適用於治療帶狀皰疹。
本品適用於治療單純皰疹病毒感染。
本品適用於預防(抑制)單純皰疹病毒感染的復發。
規格
0.5g(以伐昔洛韋計)。
用法用量
成 人
帶狀皰疹治療:口服本品500mg ,2 片,每日3次,療程7 天。單純皰疹治療:口服本品500mg,每日2 次。首次發病者病情可能較重,療程需要延長到10 天。對於復發的感染,療程應為5天。建議在前驅症狀期或剛出現症狀體徵時即開始治療。
單純皰疹病毒感染治療(抑制):
對免疫功能正常的病人,口服本品 500 mg,每日1次。
對於頻繁複發(每年≥10 次)的病人,250mg 每日2次的給藥方案效果更好。
對於免疫缺陷病人,用藥方案為 500 mg,每日2 次。
腎功能損害
對於腎功能明顯受損的病人,本品的劑量應當按下列方式調整:
腎功能(肌酐 本品劑量調整
清除率ml/min)
帶狀皰疹 單純皰疹
治療 預防
免疫功能正常 免疫缺陷
15-30 1000mg每日2次 無需調整 無需調整 無需調整
<15 1000mg每日1次 500mg每日1次 250mg每日1次 500mg每日1次
血液透析的病人,本品的劑量應當按照肌酐清除率<15ml/min 病人的推薦劑量,但應在血液透析完成後給藥。
肝功能損害
輕中度肝硬化患者(肝臟合成功能能夠維持)無需調整本品的用藥劑量。
晚期肝硬化患者(肝臟合成功能受損,出現門靜脈系統分流)的藥代動力學資料提示,不需要調整藥物劑量,但這方面的臨床經驗有限。
不良反應
根據MedDRA 人體器官分級和發生頻率將不良反應分類如下。
頻率分類標準為:
非常常見:(≥10%),
常見(≥1%,<10%),
不常見(≥0.1%,<1%),
罕見(≥0.01%,<0.1%),
非常罕見(<0.01%)。
將臨床試驗數據中的不良反應按照上述頻率標準分類,試驗數據證明不良反應與本品有關(即,接受本品和安慰劑治療的患者不良反應的發生率在統計學中有顯著性差異)。其他所有的不良事件的頻率則是根據自發上報的上市後數據來分配的。
臨床試驗數據
神經系統
常見:頭痛。
胃腸道
常見:噁心。
上市後數據
血液和淋巴系統
非常罕見:白細胞減少症,血小板減少症。
白細胞減少症主要見於免疫缺失的患者。
免疫系統
非常罕見:過敏反應。
精神和神經系統
罕見:眩暈,意識模糊,幻覺,意識喪失。
非常罕見:興奮,震顫,共濟失調,構音困難,精神病症狀,抽搐,腦病,昏迷。
以上不良反應一般是可逆的,通常見於伴有腎功能損害或其他誘病因素的患者。在預防CMV而接受高劑量鹽酸伐昔洛韋治療的器官移植患者中,神經學反應的發生率要高於低劑量組患者。
呼吸系統
不常見:呼吸困難。
胃腸道
罕見:腹部不適,嘔吐,腹瀉。
肝臟
非常罕見:肝功檢測可逆性升高。
偶有肝炎描述。
皮膚及結締組織
不常見:皮疹包括光敏反應。
罕見:瘙癢。
非常罕見:風疹,血管性水腫。
腎臟及泌尿系統
罕見:腎功能損傷。
非常罕見:急性腎衰竭,腎痛。
腎痛可能與腎衰竭有關。
其他:在延長期臨床試驗中,嚴重免疫抑制病人尤其是晚期HIV 感染者,服用大劑量(每日8g)伐昔洛韋,有腎功能不全、毛細血管溶血性貧血和血小板減少的報導(有時兩者同時存在)。上述情況也見於有相同基礎疾病或合併症,但未用伐昔洛韋治療的病人。
禁忌
本品禁用於對伐昔洛韋、阿昔洛韋或本品製劑中任何成分過敏的病人。
注意事項
體液狀態
應特別注意確保患者(尤其是老年患者)攝入足量的水分,以防止患者發生脫水現象。
腎損害患者:
對明顯腎損害患者,應當調整伐昔洛韋的劑量(參見[用法用量])。對有腎功能改變史的患者,有更高的出現神經性不良反應的危險(參見[不良反應])。
對駕駛和機械操作能力的影響
無特殊的注意事項。
孕婦及哺乳期婦女用藥
妊娠
妊娠病人使用本品的資料有限。妊娠期婦女,只有在接受治療的預期療效明顯超過危險時,方能使用。
已有的暴露於阿昔洛韋(伐昔洛韋的活性代謝產物)的妊娠婦女的研究數據顯示,其胎兒出生缺陷發生率與總體人群的胎兒出生缺陷發生率相比沒有增加,報導的胎兒缺陷沒有特別的共性,不能說明他們有共同的病因。然而,鑒於使用伐昔洛韋的記錄及數據資料有限,尚不能對在妊娠期間使用本品的安全性及可靠性得出明確的結論。
本品用藥1000mg 和3000mg 後,每日的AUC 比口服阿昔洛韋1000 mg/天能達到的AUC 高2-4 倍。
哺乳
伐昔洛韋在乳汁中分泌的主要代謝產物為阿昔洛韋。乳汁中檢測到的阿昔洛韋濃度相當於阿昔洛韋血漿濃度的0.6-4.1 倍。據估計,口服阿昔洛韋(蘇維樂®)200mg,每日5次,用藥後的平均穩態血漿峰濃度(Cmax)為3.1 μM(0.7 μg/ml)。這相當於使乳兒暴露於大約 0.3mg/天的阿昔洛韋劑量。經證實,阿昔洛韋在乳汁中的清除半衰期為2.8小時,與血漿半衰期相似。因此,當本品用於為嬰兒哺乳的婦女時,應特別謹慎。但阿昔洛韋用於治療新生兒單純皰疹的靜脈用藥劑量為30mg/kg/天。
兒童用藥
目前尚沒有治療兒科病人的資料。
老年用藥
不需調整劑量,除非腎功能明顯損害者。應維持足夠的水分。
藥物相互作用
未發現明顯的藥物相互作用。
西咪替丁和丙磺舒能通過降低腎臟的清除率使阿昔洛韋的AUC 增加,但由於阿昔洛韋治療指數較大,故無需調整劑量。影響腎臟生理的其他藥物也可能會影響阿昔洛韋的血漿水平。
藥物過量
本品用藥過量的資料有限。然而,有患者單劑使用阿昔洛韋劑量達20g,經胃腸道部分吸收後,並未出現常見的毒性反應。
意外的經口服重複過量使用阿昔洛韋幾天后,觀察到與其相關的胃腸道反應(如噁心、嘔吐)和神經系統反應(頭痛及意識模糊)。
經靜脈過量使用阿昔洛韋後會引起血漿肌氨酸酐升高,從而導致腎衰竭。亦有與靜脈過量使用阿昔洛韋有關的神經系統反應,包括意識模糊、幻覺、興奮、抽搐和昏迷。
應密切觀察患者的中毒症狀。血液透析可以顯著提高阿昔洛韋從血液中的清除率,因此,可作為過量後的處理選擇。
藥理毒理
藥理作用
藥物治療學分組:
伐昔洛韋為抗病毒製劑,是阿昔洛韋的L-纈氨酸酯。阿昔洛韋為嘌呤(鳥嘌呤)核苷類似物。
伐昔洛韋在人體內通過伐昔洛韋水解酶的作用幾乎全部快速轉化為阿昔洛韋和纈氨酸。
阿昔洛韋是皰疹病毒的特異性抑制劑,在體外具有抑制單純皰疹病毒(HSV)1 型和2 型、水痘帶狀病毒(VZV)、巨細胞病毒(CMV)、EB 病毒(EBV)和人皰疹病毒6(HHV-6)的作用。阿昔洛韋經被磷酸化轉化為有活性的三磷酸鹽形式後,即可發揮抑制病毒DNA 合成的作用。
磷酸化的第一步需要病毒特異性酶的活性。對於HSV、VZV 和EBV,該酶為病毒胸腺嘧啶激酶(TK),它僅存在於病毒感染的細胞內。這種選擇性在磷酸化的CMV 中持續存在,至少在一定程度上是由UL97 磷酸轉移酶的基因產物所介導的。阿昔洛韋活化需要病毒特異性的酶,這一條件解釋了其作用的選擇性。
磷酸化過程是通過細胞激酶的作用而完成(從單磷酸酯轉化為三磷酸鹽)。阿昔洛韋三磷酸鹽競爭性抑制病毒DNA 聚合酶,與這種核苷類似物的結合導致專需鏈的終止,中斷病毒DNA 合成,從而阻斷病毒複製。
治療帶狀皰疹的臨床試驗中,本品可減輕與帶狀皰疹相關的疼痛,包括急性疼痛和皰疹後神經痛,同時也可以縮短形成新病損的時間。
對接受阿昔洛韋治療或預防的患者的廣泛臨床監測表明,在免疫功能健全的患者中罕見對阿昔洛韋的敏感性降低,偶見於嚴重免疫缺陷的病人,如實體器官或骨髓移植患者、接受化療的惡性腫瘤病人以及人類免疫缺陷病毒(HIV)感染者。
耐藥性一般是胸腺嘧啶激酶缺陷表型引起的,這種缺陷表型使病毒在自然宿主體內處於非常不利的境地。少數情況下,對阿昔洛韋的敏感性降低可能是由病毒胸腺嘧啶激酶或DNA 聚合酶的突變引起。這些變異株的毒力與野生型病毒株相似。
毒性研究
致突變作用:體內和體外致突變試驗結果表明,伐昔洛韋對人類不具有遺傳危險性。
致癌作用:大小鼠的生物測定表明,伐昔洛韋無致癌作用。
致畸性:伐昔洛韋對大鼠和家兔沒有致畸作用,幾乎全部代謝為阿昔洛韋。
在國際認可的實驗中,大鼠和家兔皮下注射阿昔洛韋沒有出現致畸作用。在另外的大鼠研究中,皮下給藥血漿濃度達到100 μg/ml 時發現有胎鼠異常,並引起母鼠中毒。
生殖力:伐昔洛韋口服給藥不影響雄性和雌性大鼠的生殖力。
藥代動力學
一般特徵:
伐昔洛韋口服吸收完全、快速,幾乎全部轉化為阿昔洛韋和纈氨酸。這一轉化過程可能通過人體肝臟中伐昔洛韋水解酶的分離酶來完成。
1000 mg 伐昔洛韋中阿昔洛韋的生物利用度為54%,並不受食物影響。500 mg 伐昔洛韋,每日2 次給藥時阿昔洛韋的生物利用度比伐昔洛韋200mg,每日5 次給藥時阿昔洛韋的生物利用度高2.6 倍。
伐昔洛韋1000 mg ,每日3 次口服給藥後,阿昔洛韋每日的AUC(血藥濃度-時間曲線下面積)比與伐昔洛韋800 mg,每日5 次口服給藥後的AUC 值高2 倍。
伐昔洛韋500mg 每日2 次用藥後,阿昔洛韋的Cmax 和每日AUC 分別比伐昔洛韋200mg 每日用藥5 次的預測值高4 倍和1.8 倍以上。
單劑服用伐昔洛韋250 -1000 mg 後,阿昔洛韋的平均峰濃度為10-25 μM (2.2-5.7 μg/ml),平均達峰時間為用藥後的1.5 小時。
伐昔洛韋的血漿峰濃度僅為阿昔洛韋的4%,平均達峰時間為用藥後的30-60 分鐘,用藥3 小時後血藥濃度降低到可檢測水平以下。單劑和多劑用藥後,伐昔洛韋和阿昔洛韋的藥代動力學特徵相似。阿昔洛韋與血漿蛋白的結合率很低(15%)。
伐昔洛韋單劑和多劑用藥後,阿昔洛韋的血漿清除半減期約為3 小時。尿液中伐昔洛韋原形的量不到攝入量的1%。伐昔洛韋在尿液中主要以阿昔洛韋和已知的阿昔洛韋代謝產物9-羧甲氧甲酯鳥嘌呤(CMMG)被清除。
病人中的藥代動力學
帶狀皰疹和單純皰疹對口服本品後的伐昔洛韋和阿昔洛韋藥代動力學特徵沒有明顯影響。
HIV 感染的病人單劑或多劑口服伐昔洛韋1000mg 或2000mg 後,阿昔洛韋的分布和藥代動力學特徵與健康人相比無明顯變化。
貯藏
30℃以下存放。
包裝
鋁塑包裝 10 片/盒;42 片/盒。
有效期
36個月。
執行標準
進口藥品註冊標準 JX20040245
生產企業
Glaxo Wellcome, S.A.
核准日期
2007年2月20日
修訂日期
2008年2月20日