1. 引言
細胞周期是一個受嚴密調控的有序發生的事件,基因組DNA完成複製,隨後基因組均等地分裂成兩個相似的細胞。細胞分裂周期最初被分為兩期,有絲分裂期和分裂間期。1953年隨著Watson and Crick詳細地描述了DNA雙螺旋結構模型,幾乎在同時Howard and Pelc 最終把細胞周期分為四期:G1,S,G2和M期。
細胞是否能順利完成增殖過程與細胞能否順利地從細胞周期的上一階段進入下一階段密切相關,這些過程受到極其精準的調控。真核細胞能夠使細胞周期事件正確地開啟和結束,依賴於細胞內一個複雜的調控系統,即細胞周期調控系統。
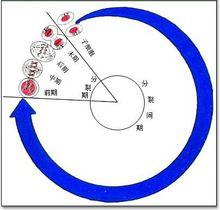 細胞周期阻滯
細胞周期阻滯圖1 細胞周期分期
2. 細胞周期各期的特點
G0期是靜止期,不包括在細胞周期之中。通常認為在正常條件下,腎小管上皮細胞處於G0期,也有數據表明大鼠腎小管上皮細胞處於G1期。
G1期的特點是細胞體積增長以及合成DNA複製所需要的mRNA和蛋白質。
S期是DNA複製期。
G2期是細胞快速增長期以及有絲分裂期之前的蛋白質合成期。
M期是細胞生長停止以及有序的進行有絲分裂期。
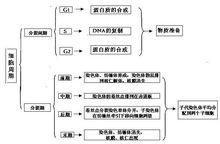 細胞周期阻滯
細胞周期阻滯圖2 細胞周期各期的特點
3. 細胞周期進展的調控
(1) 細胞周期檢查點
為了確保細胞周期有序進展,有許多被稱為細胞周期檢查點蛋白的質量控制點。細胞周期檢查點是細胞增殖調控的關鍵位點。這些檢測點蛋白能及時修復問題以保證細胞周期安全有序進行。目前,依據細胞周期的順序循環分為:G1-S期檢查點,S期檢查點,G2期檢查點和M期檢查點。
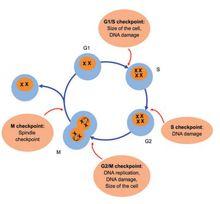 細胞周期阻滯
細胞周期阻滯圖3 細胞周期檢查點
G1-S期檢查點決定細胞是否增殖。細胞在該檢查點對各種複雜的細胞內外信號進行整合和傳遞,根據檢查結果決定細胞是否進行分裂,發生凋亡或進入G0期。 S期檢查點可阻止DNA受損的細胞進行DNA合成 。可以檢測DNA是否發生損傷,損傷的DNA分子是否得到修復,從而避免DNA得以複製傳代。 G2期檢查點阻止受損細胞進入有絲分裂 ,可防止細胞攜帶著受損的DNA和未複製的DNA進入有絲分裂。M期檢查點又稱紡錘體檢查點,可阻止受損細胞進行分裂 ,監測姐妹染色單體是否已穩定地附著在紡錘體上,若未通過檢查,細胞被阻止繼續進行分裂。
(2) 細胞周期檢查點由多種調控蛋白控制
細胞周期有序地進展是受到細胞周期蛋白及細胞周期蛋白依賴性激酶(CDK)有序的合成,激活,嚴格的劃分及降解實現的。
1982年,Tim Hunt and Tom Evans首先報導了一種蛋白稱為細胞周期蛋B(cyclin B)
隨後研究發現,cyclin D在G1早期合成,當細胞離開G1期進入S期時降解。Cyclin E在G1晚期合成,在S期降解;cyclin A在S期合成,當細胞通過S期離開G2期降解。CyclinB在G2晚期合成,在M晚期降解。
細胞周期依賴性蛋白激酶(CDK)屬於蛋白質絲氨酸/蘇氨酸激酶家族,可以催化來自ATP的磷酸基團與底物的絲氨酸/蘇氨酸殘基共價結合。CDK單獨存在時不表現激酶活性,只有與其調節亞基cyclin結合時才表現出激酶活性。CDK的表達水平比較恆定,但由於cyclin的表達水平變化巨大,CDK的激酶活性在細胞周期中呈現明顯的震盪變化。
4 細胞期周阻滯與疾病
細胞周期調控需要大量的胞內外信號的配合,如果缺乏適當的信號,細胞將不能從一個階段進入下一個階段,這種現象稱為細胞周期阻滯。細胞周期阻滯有助於維持基因的穩定性,細胞周期調控的基因突變在腫瘤的發生中發揮重要作用。當細胞周期正常時,如果DNA出現損傷,細胞周期停在相應檢查點,細胞周期阻滯為細胞提供額外的時間用於修復損傷,從而減少突變的發生,避免腫瘤的產生。
有研究表明,當發生急性腎損傷時,大多數腎小管發生可逆性損傷,可以得到修復,恢復小管功能;如果損傷因素持續存在,腎小管上皮細胞不能進行正常的修復過程,則發生G2/M期阻滯,阻滯的腎小管上皮細胞分泌大量的TGF-β,CTGF等纖維化因子以及持續激活成纖維細胞,導致成纖維細胞持續分泌膠原,Fibronecin等細胞外基質,導致腎臟纖維化的發生。
因此,對於細胞周期以及細胞周期調控的研究,對於一些與細胞周期有關疾病的預防和治療有極其重要的意義。
參考資料:
[1]. 王海燕, 張敏與鄒萍, 細胞周期檢測點激酶1的研究進展. 醫學分子生物學雜誌, 2005(02): 第147-149頁.
[2]. Cell Cycle Events During Renal Injury.
[3]. STUART J. SHANKLAND Cell-cycle control and renal disease. Kidney International, Vol. 52 (1997), pp. 294 —308
[4]. Kellum, J.A. and L.S. Chawla, Cell-cycle arrest and acute kidney injury: the light and the dark sides. Nephrology Dialysis Transplantation, 2015. Jun 4. pii: gfv130
[5]. Price, P.M., R.L. Safirstein and J. Megyesi, The cell cycle and acute kidney injury. Kidney International, 2009. 76(6): p. 604-613.
[6]. Hayashi, M.T., et al., Cell death during crisis is mediated by mitotic telomere deprotection. Nature, 2015. 522(7557): p. 492-496.
[7]. Wynn, T.A., Fibrosis under arrest. Nat Med, 2010. 16(5): p. 523-5.
[8]. Bollen M ,et al,Cell cycle:It takes three to find the exit. Nature.2015 Jan 1;517(
7532):29-30. doi: 10.1038/nature14080
[9]. 朱虹, 繆澤鴻與丁健, ATM、ATR和DNA損傷介導的細胞周期阻滯. 生命科學, 2007(02): 第139-148頁.
[10]. Yang, L., et al., Epithelial cell cycle arrest in G2/M mediates kidney fibrosis after injury. Nature Medicine, 2010. 16(5): p. 535-543.
[11]. Lovisa, S., et al., Epithelial-to-mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis. Nature Medicine, 2015. 21(9): p. 998-1009.
[12]. Bechtel, W., et al., Methylation determines fibroblast activation and fibrogenesis in the kidney. Nature Medicine, 2010. 16(5): p. 544-550.
[13]Guillaume Canaud1 and Joseph V. Bonventre Cell cycle arrest and the evolution of chronic kidney disease from acute kidney injury Nephrol Dial Transplant (2014) 0: 1–9doi:10.1093/ndt/gfu230
