常見方法
為了便於研究和掌握物質的性質,人們按照一定的分類標準對物質進行分類,分類是學習和研究化學物質及其變化的一種常用的基本方法,它不僅可以使有關化學物質及其變化的知識系統化,還可以通過分門別類的研究,了解物質及其變化的規律。分類要有一定的標準,根據不同的標準可以對化學物質及其變化進行不同的分類。交叉分類法和樹狀分類法是常用的分類的方法。
交叉分類法
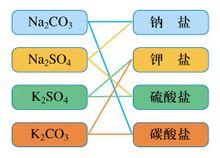 交叉分類法
交叉分類法一種分類方法所依據的標準有一定局限,所能提供的信息少,人們在認識事物時往往需要採用多種分類方法來彌補單一分類方法的不足。在給物質進行分類時,採用交叉分類法能從不同角度對物質進行較全面的分析,如對於鹽的分類就可以從陰、陽離子的角度來進行。又如在國中時,我們可以根據反應物和生成物的類別以及反應前後物質種類的多少,把化學反應分為化合反應、分解反應、置換反應和複分解反應四種基本反應類型。再如根據物質在反應中是否得到氧或失去氧,把化學反應分為氧化反應和還原反應。像C + O2 CO2這個反應,按照前一種分類方法屬於化合反應,按照後一種分類方法屬於氧化反應(在高中階段對於氧化還原反應的概念還會有新的界定)。不同的分類方法是為了從不同角度研究問題的需要,在後面的學習中,我們還會根據反應中是否有離子參加將化學反應分為離子反應和非離子反應。
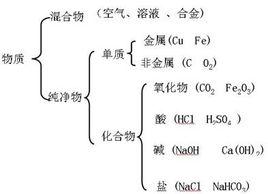
樹狀分類法
任何科學,為了研究,首先要對研究對象進行分類,樹狀分類法在化學中有著廣泛的套用(即對同類事物按照某種屬性進行分類)對我們學習化學會有很大的幫助。化學研究的近千萬種物質,可以從不同角度、按不同層次對它們進行多種分類:根據組成的成分是一種物質還是幾種物質,把物質分為純淨物和混合物;根據組成純淨物的元素是一種還是幾種,把物質分為單質和化合物;根據單質的性質把單質分為金屬和非金屬;根據化合物電離出的陽離子是否是氫離子,及是否全部是氫離子,或者陰離子是否全部是氫氧根離子,把某些化合物分為酸、鹼、鹽。酸是在水溶液中發生電離,生成的陽離子全部是水合氫離子的化合物。根據酸在水溶液中電離度的大小,酸分為強酸和弱酸。
根據酸分子中可以電離的氫原子個數,酸分為一元酸(如HNO3)、二元酸(如H2SO4)和三元酸(如H3PO4)。根據酸中是否含氧,酸分為含氧酸和無氧酸。無氧酸稱氫某酸。如HF叫氫氟酸,H2S叫氫硫酸。在無氧酸中,HCl、HBr和HI是強酸,其餘都是弱酸。簡單含氧酸通常叫某酸,如硫酸(H2SO4)、碳酸(H2CO3)。某一成酸元素如果能形成多種含氧酸,就按成酸元素的化合價的高低命名,如高氯酸(HClO4)、氯酸(HClO3)、亞氯酸(HClO2)、次氯酸(HClO)。
鹼是在水溶液中發生電離,生成的陰離子全部是氫氧根離子的化合物。根據鹼在水溶液中的電離程度,鹼分成強鹼和弱鹼。能全部電離的是強鹼,包括鹼金屬和鈣、鍶、鋇的氫氧化物;只能部分電離的是弱鹼,其他的氫氧化物都是弱鹼。
鹽是由金屬離子(包括NH4+)和酸根離子組成的化合物。根據組成不同,鹽可以分成正鹽、酸式鹽、鹼式鹽、復鹽和絡鹽等。既不含可以電離的氫原子,又不含氫氧根,這種鹽叫正鹽。由金屬離子和含有可以電離出氫原子的酸根所組成的鹽,叫做酸式鹽,如KHSO4、NaHCO3和NaH2PO4,它們分別叫硫酸氫鉀、碳酸氫鈉和磷酸二氫鈉。除金屬離子和酸根以外,還含有一個或幾個氫氧根,這種鹽叫鹼式鹽,如Cu2(OH)2CO3(鹼式碳酸銅)。復鹽是由兩種或兩種以上的金屬陽離子和一種酸根離子組成,如KAl(SO4)2·12H2O(明礬)。絡鹽(高中階段不深入研究),如Fe(SCN)3。
化合物中還包括氧化物,在氧化物中,凡是能與鹼反應只生成鹽和水的氧化物稱酸性氧化物,酸性氧化物也叫酸酐。多數非金屬氧化物,少數金屬高價態氧化物(如Mn2O7、CrO3)屬於酸性氧化物。凡是能與酸反應只生成鹽和水的氧化物稱鹼性氧化物。鹼性氧化物一定是金屬氧化物。既能與酸,又能與鹼生成鹽和水的氧化物為兩性氧化物,如Al2O3、ZnO等。既不能與酸反應生成鹽和水,也不能與鹼反應生成鹽和水的氧化物稱不成鹽氧化物。如CO、NO、H2O等。
套用
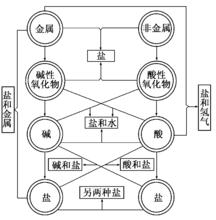 單質、氧化物、酸、鹼、鹽的轉化關係
單質、氧化物、酸、鹼、鹽的轉化關係⑴單質、氧化物、酸、鹼、鹽之間的轉化關係。給物質進行分類,有利於更好地認識物質的性質以及各類物質之間的轉化關係。⑵化學反應的分類。以上轉化涉及多種類型的化學反應,對化學反應進行分類,能更好的理解各類物質的性質及其轉化關係。①化合反應
| 金屬與非金屬 | 2Na+Cl2=(條件為點燃)2NaCl |
| 鹼性氧化物+水 | CaO+H2O=Ca(OH)2 |
| 酸性氧化物+水 | CO2+H2O=H2CO3 |
| 鹼性氧化物+酸性氧化物 | CaO+CO2=(條件為高溫)CaCO3 |
②分解反應如鹽的分解:CaCO3=(條件為高溫)CaO+CO2↑ ③置換反應
| 金屬+酸 | Mg+2HCl=MgCl2+H2↑ |
| 金屬+鹽 | Cu+2AgNO3=Cu(NO3)2+2Ag |
④複分解反應
| 酸+鹽 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
| 鹼+鹽 | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH |
| 酸+鹼 | NaOH+HCl=NaCl+H2O |
| 鹽+鹽 | NaCl+AgNO3=AgCl↓+NaNO3 |