穩態近似法
直鏈反應(H2和Cl2反應歷程)——穩態近似法
H2(g)和Cl2(g)的反應淨結果是:
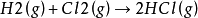 穩態近似法
穩態近似法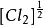 穩態近似法
穩態近似法根據很多人的研究生成HCl的速率即與
成正比,又與[H]的一次方成正比,即:
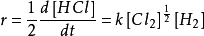 穩態近似法
穩態近似法 反應歷程表
反應歷程表據此推測反應歷程和相應的活化能如表:
這個反應可以用鹽酸的生成速率來表示:
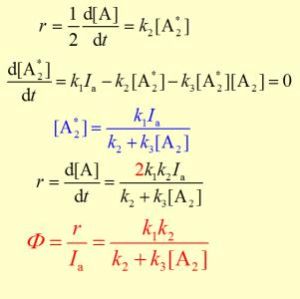 穩態近似法
穩態近似法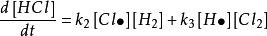 穩態近似法
穩態近似法(a)
這個反應速率不但涉及反應物H2和Cl的濃度,而且還涉及到活潑性很大的Cl∙和H·的濃度。由於Cl·和H·等中間產物很活潑,它們只要碰上任何分子或其他的自由基都將立即反應,所以在反應過程中濃度很低,並且壽命很短,用一般的實驗方法難以測定它們的濃度。同時反應過程中許多中間化合物和許多複雜的連續反應,若嚴格找出各物種與濃度之間的關係,則需給出許多微分方程,然後聯立求解。這很難辦到。採用穩態近似法,可以簡化問題,它能夠以幾個代數方程替代許多微分方程。
由於自由基等中間產物極活潑,它們參與許多反應,但是濃度低,壽命又短,可以近似地認為在反應達到穩定狀態後,它們的濃度基本上不隨時間而變化,即
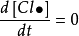 穩態近似法
穩態近似法這樣處理的方法叫穩態近似法。
根據上述H和Cl反應的歷程,用穩態近似法處理,得:
 穩態近似法
穩態近似法(b)
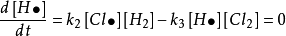 穩態近似法
穩態近似法(c)
將(c)式帶入(b)式,得
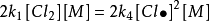 穩態近似法
穩態近似法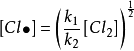 穩態近似法
穩態近似法(d)
將(c)式,(d)式帶入(a)式得
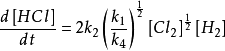 穩態近似法
穩態近似法所以
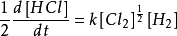 穩態近似法
穩態近似法(e)
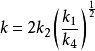 穩態近似法
穩態近似法式中
。根據這個速率方程,H和Cl的反應為1.5級反應。
英文解釋
網路釋義
stableapproximatetreatment
穩態近似處理法;連續反應;速率常數[gap=2535]Keywords:stableapproximatetreatment;continuousreaction;rateconstant
注意事項
因為只有在流動的敞開系統中,控制必要的條件,有可能使反應系統中各物質的濃度保持一定,不隨時間而變。而在封閉系統中,由於反應物濃度不斷下降,生成物濃度不斷增高,要保持中間產物濃度不隨時間而變,嚴格的講是不太可能的。隨意說穩態近似法只是一種近似方法,但確能解決很多問題。
