發現歷史
碳的英文名稱 carbon來源於拉丁文中煤和木炭的名稱 carbo,也來源於法語中的 charbon,意思是木炭。 在德國、荷蘭和丹麥,碳的名字分別是 Kohlenstoff、 koolstof、 kulstof,字面意思是煤物質。
碳在史前就已被發現,炭黑和煤是人類最早使用碳的形式。鑽石大約在公元前2500年被中國熟知 ,同時煤作為碳的形式在羅馬時代被使用的化學方式和現代一樣:通過在一個椎體建築物中加熱被黏土覆蓋的木材來排除空氣。 在1722年,René Antoine Ferchault de Réaumur證明鐵通過吸收一些物質能變成鋼,這種物質就是現在熟知的碳。 在1772年,安東尼·拉瓦錫表明鑽石是碳的一種存在形式,當他將一些鑽石和煤的樣品燃燒時,發現他們都不生成水,並且每克的鑽石和煤所產生的二氧化碳的量是相等的。在1779年,卡爾·威廉·舍勒表明一度被認為是鉛的存在形式的石墨實質上是混雜了少量鐵的碳的混合物 ,並且他給了當用硝酸氧化時,產物的名字 空氣中的酸(" aerial acid"),即二氧化碳。 在1786年,法國化學家Claude Louis Berthollet,Gaspard Monge 和 C. A. Vandermonde通過利用拉瓦錫處理鑽石的方法將石墨氧化,證明了石墨幾乎全部由碳組成。 1789年,拉瓦錫在他的教科書中將碳列在元素表中。
存在分布
礦藏形式
碳既以游離元素存在(金剛石、石墨等),又以化合物形式存在(主要為鈣、鎂以及其他電正性元素的碳酸鹽)。它以二氧化碳的形式存在,是大氣中少量但極其重要的組分。預計碳在地殼岩石中的總豐度變化範圍相當大,但典型的數值可取180ppm;按豐度順序,這個元素位於第17位,在鋇、鍶、硫之後,鋯、釩、氯、鉻之前。 石墨廣泛分布於全世界,然而大多數幾乎沒有價值。大量的晶體或薄片存在於變性的沉積矽酸鹽岩石中,如石英、雲母、片岩和片麻岩;晶體大小從不足1mm到6mm左右(平均4mm)。它沉積微扁豆狀礦體,可達30m厚,橫越田野,綿延數公里。平均含碳量達25%,但高的可達60%(馬爾加什)。選礦是利用氫氟酸和鹽酸處理後進行浮選,再在真空中加熱到1500℃。微晶石墨(有時稱為“無定形體”)存在於富碳的變性沉澱中,某些墨西哥的沉積物含有高達95%的碳。
金剛石出自古代火山的筒狀火成礫岩(火山筒),它嵌在一種比較柔軟的、暗色的鹼性岩石中,稱為“藍土”或“含鑽石的火成岩”,1870年在南非的吉姆伯利城,首次發現這樣的火山筒。 隨著地質年代的變遷,借火山筒的風化腐蝕,在沖刷砂礫中和海灘上也能找到金剛石。形成金剛石結晶的原始模式當代仍然是積極研究的課題。典型的含鑽石火山筒中金剛石的含量極低,數量級為500萬分之一,礦物必須用粉碎、淘洗這類機械方法分離並使其從塗有油膏的皮帶上通過,金剛石會粘在上面。這在某種程度上說明了寶石級金剛石價格極高的原因。
三種其他形式的碳被大規模製造並廣泛運用於工業:它們是焦炭、炭黑和活性炭。
自然界中的循環
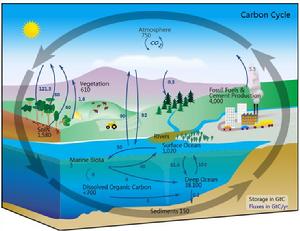 碳循環的模式圖
碳循環的模式圖在地麵條件下,一種元素從一處到另一處是很罕見的。因此,地球上的碳含量是一個有效常數。碳在自然界中的流動構成了碳循環。例如,植物從環境中吸收二氧化碳用來儲存生物質能,如碳呼吸和 卡爾文循環(一種碳固定的過程)。一些生物質能通過捕食而轉移,而一些碳以二氧化碳的形式被動物呼出。碳循環的結構要比右圖的模式圖複雜得多。例如,一些二氧化碳會溶解在海洋中,死去的植物或動物的遺骸可能會形成煤、石油和天然氣,這些可以通過燃燒釋放碳,而細菌不能利用得到。
恆星中的形成
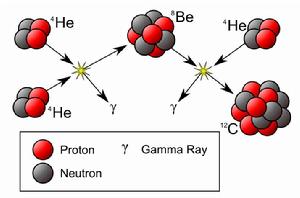 3氦過程概貌
3氦過程概貌碳原子核的形成需要α粒子(氦核)在巨核或超巨星中發生幾乎同時的三重碰撞,這個過程稱為 三氦過程。這種核融合反應可以在超過一億度K的高溫和氦含量豐富的恆星內部迅速的發生。同樣的,他發生在較老年,經由質子-質子鏈反應和碳氮氧循環產生的氦,累積在核心的恆星。在核心的氫已經燃燒完後,核心將塌縮,直到溫度達到氦燃燒的燃點。反應的過程是:
He+ He→ Be (−93.7 keV)
Be+ He→ C (+7.367 MeV)
反應過程的淨能量釋放為1.166pJ。
另一個為恆星供能的融合機制是 CNO循環( 碳-氮-氧循環,有時也稱為 貝斯-魏茨澤克-循環,是恆星將氫轉換成氦的兩種過程之一,另一種過程是 質子-質子鏈反應),其中碳作為催化劑使得反應能夠進行。
物理性質
同位素
現代已知的同位素共有十五種,有碳8至碳22,其中碳12和碳13屬穩定型,其餘的均帶放射性,當中碳14的半衰期長達5730年,其他的為穩定同位素。 在地球的自然界裡,碳12在所有碳的含量占98.93%,碳13則有1.07%。C的原子量取碳12、13兩種同位素豐度加權的平均值,一般計算時取12.01。碳12是國際單位制中定義摩爾的尺度,以12克碳12中含有的原子數為1摩爾。碳14由於具有較長的半衰期,衰變方式為β衰變,碳14原子轉變為氮原子 且碳是有機物的元素之一,生物在生存的時候,由於需要呼吸,其體內的碳14含量大致不變,生物死去後會停止呼吸,此時體內的碳14開始減少。人們可透過傾測一件古物的碳14含量,來估計它的大概年齡,這種方法稱之為碳定年法。
| 符號 | 質子 | 中子 | 質量(u) | 半衰期 | 核自旋 | 相對豐度 | 相對豐度變化量 |
| C | 6 | 2 | 8.037675(25) | 2.0(4) x 10s[230(50) keV] | 0+ | ||
| C | 6 | 3 | 9.0310367(23) | 126.5(9) ms | (3/2-) | ||
| C | 6 | 4 | 10.0168532(4) | 19.290(12) s | 0+ | ||
| C | 6 | 5 | 11.0114336(10) | 20.334(24) min | 3/2- | ||
| C | 6 | 6 | 12 by definition | 穩定 | 0+ | 0.9893(8) | 0.98853-0.99037 |
| C | 6 | 7 | 13.0033548378(10) | 穩定 | 1/2- | 0.0107(8) | 0.00963-0.01147 |
| C | 6 | 8 | 14.003241989(4) | 5.70(3) x 10 years | 0+ | ||
| C | 6 | 9 | 15.0105993(9) | 2.449(5) s | 1/2+ | ||
| C | 6 | 10 | 16.014701(4) | 0.747(8) s | 0+ | ||
| C | 6 | 11 | 17.022586(19) | 193(5) ms | (3/2+) | ||
| C | 6 | 12 | 18.02676(3) | 92(2) ms | 0+ | ||
| C | 6 | 13 | 19.03481(11) | 46.2(23) ms | (1/2+) | ||
| C | 6 | 14 | 20.04032(26) | 16(3) ms [14(+6-5) ms] | 0+ | ||
| C | 6 | 15 | 21.04934(54)# | <30 ns | (1/2+)# | ||
| C | 6 | 16 | 22.05720(97)# | 6.2(13) ms [6.1(+14-12) ms] | 0+ |
備註:畫上#號的數據代表沒有經過實驗的證明,只是理論推測而已,而用括弧括起來的代表數據不確定性。
同素異形體
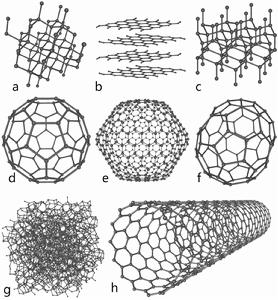 一些碳的同素異形體
一些碳的同素異形體金剛石 碳以無煙煤(一種煤炭類型),石墨和鑽石的形式天然的存在,歷史上更容易得到的是煤灰或木炭。最終這些不同的材料被認為是由相同的元素形成的。不驚奇的是,鑽石是最難確認的。來自佛羅倫斯(義大利)的博物學者Giuseppe Averani和醫學工作者Cipriano Targioni首先發現了鑽石是可以被加熱摧毀的。在1694年他們使用一個大型放大鏡聚集陽光到鑽石上,寶石最終消失了。Pierre-Joseph Macquer和Godefroy de Villetaneuse在1771年重複了這個實驗。之後,在1796年,英國化學家Smithson Tennant展示其燃燒後生成的僅僅是CO而最終證明了鑽石只是碳的一種形式。(結構如圖a)
金剛石是最為堅固的一種碳結構,其中的碳原子以晶體結構的形式排列,每一個碳原子與另外四個碳原子緊密鍵合,成空間網狀結構,最終形成了一種硬度大、活性差的固體。金剛石的熔沸點高,熔點超過3500℃,相當於某些恆星表面溫度。在金剛石分子中,每一個碳原子都被另外四個碳原子包圍著,這些碳原子以很強的結合力連線在一起,形成了一個巨大的分子,因此金剛石很堅硬。金剛石是絕緣體。用途是作裝飾品,鑽頭材料等。
石墨 石墨是一種深灰色有金屬光澤而不透明的細鱗片狀固體。石墨屬於混合型晶體,既有原子晶體的性質又有分子晶體的性質。質軟,有滑膩感,具有優良的導電性能。熔沸點高。石墨分子中每一個碳原子只與其他三個碳原子以較強的力結合,形成了一種層狀的結構,而層與層之間的結合力較小,因此石墨可以作為潤滑劑。用途是製作鉛筆,電極,電車纜線等。(結構如圖b)
足球烯 1985年由美國德克薩斯州羅斯大學的科學家發現。一個C60分子中有60個C原子,構成32個面,20個正六邊形,12個正五邊形。富勒烯中的碳原子是以球狀穹頂的結構鍵合在一起。(結構如圖d,e,f)屬於分子晶體,熔沸點低,硬度小,絕緣。
藍絲黛爾石(Lonsdaleite,與金剛石有相同的鍵型,但原子以六邊形排列,也被稱為六角金剛石)(結構如圖c)
蠟石(Chaoite,石墨與隕石碰撞時產生,具有六邊形圖案的原子排列)
汞黝礦結構(Schwarzite,由於有七邊形的出現,六邊形層被扭曲到“負曲率”鞍形中的假想結構) 碳纖維(Filamentous carbon,小片堆成長鏈而形成的纖維)
碳氣凝膠(Carbon aerogels,密度極小的多孔結構,類似於熟知的矽氣凝膠)
碳納米泡沫(Carbon nanofoam,蛛網狀,有分形結構,密度是碳氣凝膠的百分之一,有鐵磁性)
石墨烯 是一種二維晶體,最大的特性是其中電子的運動速度達到了光速的1/300,遠遠超過了電子在一般導體中的運動速度。這使得石墨烯中的電子,或更準確地,應稱為“載荷子”(electric charge carrier),的性質和相對論性的中微子非常相似。人們常見的石墨是由一層層以蜂窩狀有序排列的平面碳原子堆疊而形成的,石墨的層間作用力較弱,很容易互相剝離,形成薄薄的石墨片。當把石墨片剝成單層之後,這種只有一個碳原子厚度的單層就是石墨烯。
其他結構 無定形碳(Amorphous,不是真的異形體,內部結構是石墨)(結構如圖g)
化學性質
單質
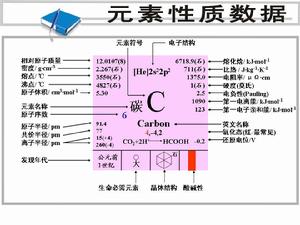 元素性質數據
元素性質數據在氧氣中燃燒
劇烈放熱,發出刺眼白光,產生無色無味能使氫氧化鈣溶液(澄清石灰水)變渾濁的氣體
化學方程式:
C+O====CO(化合反應)
在空氣中燃燒
放熱,持續紅熱,產生無色無臭能使氫氧化鈣溶液(澄清石灰水)變渾濁的氣體CO;當燃燒不充分,即氧氣量不足時,產生一氧化碳:
氧氣充足時化學方程式:
C+O====CO(化合反應)
氧氣不足時化學方程式:
2C+O====2CO(化合反應)
作為還原劑
碳作為還原劑擁有和氫氣、一氧化碳相似的化學性質(但生成物不同),都可以從金屬氧化物中還原出金屬單質。
碳還原氧化銅:
C+2CuO====2Cu+CO↑(置換反應)
碳還原氧化鐵:
3C+2FeO====4Fe+3CO↑(置換反應)
碳還原二氧化碳:
C+CO====2CO(化合反應)
但是,碳在密封空間與高錳酸鉀共熱,高錳酸鉀會分解出氧氣,碳會迅速氧化,會發生爆炸。
與強氧化性酸反應:
C+2H2SO4(濃)==加熱==CO2↑+2SO2↑+2H2O
C+4HNO3(濃)==加熱==CO2↑4NO2↑+2H2O
穩定性
碳在“常溫”下具有穩定性,不易反應,故古代名畫現代能保存,書寫檔案要用碳素墨水
化合物
碳的化合物中,只有以下化合物屬於無機物:碳的氧化物、碳化物、碳的硫屬化合物、二硫化碳(CS)、碳酸鹽、碳酸氫鹽、氰及一系列擬鹵素及其擬鹵化物、擬鹵酸鹽,如氰[(CN)]、氧氰[(OCN)],硫氰[(SCN)],其它含碳化合物都是有機化合物。
由於碳原子形成的鍵都比較穩定,有機化合物中碳的個數、排列以及取代基的種類、位置都具有高度的隨意性,因此造成了有機物數量極其繁多這一現象,現代人類發現的化合物中有機物占絕大多數。有機物的性質與無機物大不相同,它們一般可燃、不易溶於水,反應機理複雜,已形成一門獨立的分科——有機化學。
毒理性質
純碳具有極低的對人體的毒性,並可以處理,甚至可以以石墨或活性炭的形式安全地攝取。碳可以抵抗溶解或化學侵蝕,例如,即使是面對消化道內的酸性物質。因此它一旦進入人體組織後可能會無期限存留。炭黑可能是最早用來紋身的顏料之一,如冰人奧茲被發現有炭黑紋身,這些紋身從他存活開始一直到他死後5200年後都一直存在。 然而,吸入大量煤炭(或炭黑)粉塵或煙塵是危險的,它們會刺激肺組織,並引起充血性肺病 煤工塵肺。相似的,金剛石磨粉被誤食或吸入也會有危險。
碳對地球上幾乎所有生物都是低毒的,然而對某些生物是有毒的,例如碳納米顆粒對 果蠅是致命的。 碳化合物種類繁多,既有致命毒素如河豚毒素、從 蓖麻種子中提取的蓖麻毒素、氰化物和一氧化碳等,也有生命必需物種如葡萄糖、蛋白質。
製取方法
金剛石
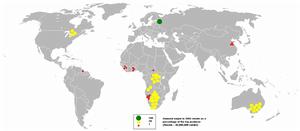 2005年全球鑽石產量
2005年全球鑽石產量金剛石供應鏈被有權利的貿易集團控制在有限數量上,並且高度集中在世界上很小的區域內。(如右圖)只有非常少量的礦藏有實際價值。在將礦石粉碎期間必須採取護理措施防止在此過程中金剛石遭到破損,並隨後將金剛石按照密度順序排序。在當今藉助X射線將鑽石按照富集密度分級之前,過程中最後的分揀步驟都是靠手工完成的。在藉助X射線操作成為了家常便飯之前,分離是通過塗有油膏的皮帶完成的,鑽石比其他礦物更有粘附能力。
石墨
有商業價值的石墨沉積在世界各地都有,但最重要的經濟來源是在中國、印度、巴西和朝鮮。在Borrowdale , Cumberland , England的石墨沉積是首先達到了足夠的大小和純度,在19世紀前,鉛筆通過簡單地用木條將天然石墨鋸條包裹而成。二十一世紀後,小的石墨沉積通過粉碎母岩並使輕質的石墨浮出水面獲得。
套用領域
碳對於現有已知的所有生命系統都是不可或缺的,沒有它,生命不可能存在。
除食物和木材以外的碳的主要經濟利用是烴(最明顯的是石油和天然氣)的形式。原油由石化行業在煉油廠通過分餾過程來生產其他商品,包括汽油和煤油。
纖維素是一種天然的含碳的聚合物,從棉、麻、亞麻等植物中獲取。纖維素在植物中的主要作用的維持植物本身的結構。來源於動物的具有商業價值的聚合物包括羊毛、羊絨、絲綢等都是碳的聚合物,通常還包括規則排列在聚合物主鏈的氮原子和氧原子。
碳及其化合物多種多樣。碳還能與鐵形成合金,最常見的是碳素鋼;石墨和黏土混合可以制用於書寫和繪畫的鉛筆芯,石墨還能作為潤滑劑和顏料,作為玻璃製造的成型材料,用於電極和電鍍、電鑄,電動馬達的電刷,也是核反應堆中的中子減速材料;焦炭可以用於燒烤、繪圖材料和煉鐵工業;寶石級金剛石可作為首飾,工業用金剛石用於鑽孔、切割和拋光,以及加工石頭和金屬的工具。
![碳[元素] 碳[元素]](/img/2/fb7/nBnauM3X3QDOyMDM3UDNwADO1UTM1QDN5MjM5ADMwAjMwUzL1QzLzUzLt92YucmbvRWdo5Cd0FmLzE2LvoDc0RHa.jpg)
