定義
當非極性分子相互靠近時,由於電子的不斷運動和原子核的不斷振動,要使每一瞬間正、負電荷中心都重合是不可能的,在某一瞬間總會有偶極存在,這種偶極叫做瞬間偶極。瞬間偶極之間總是處於異極相吸的狀態。
產生原因
分子與分子之間,某些較大分子的基團之間,或小分子與大分子內的基團之間,還存在著各種各樣的作用力,總稱分子間作用力。分子間作用力又稱為范德華力(van der Waals force)。由於分子間作用力比化學鍵弱得多(化學鍵的鍵能數量級汰10 ~10 KJ/mol,而分子間力的能量只達幾個~幾十個KJ/mol的數量級),所以分子晶體的熔點,沸點往往比較低。
分子間作用力(范德華力)與偶極矩有關。偶極矩是表示分子中電荷分布狀況的物彈量用μ表示.定義為正、負電荷重心間的距離r與電荷量q的乘積:
μ=q×r
偶極矩是個矢量,正負電荷的重心重合時偶極矩為零(非極性分子);正、負電荷的重心不重合時分子的偶極矩不為零(極性分子)。
如HO分子和NH分子的偶極矩之和都不為零,為極性分子,其固有的偶極叫永久偶極(permanent dipole),非極性分子在極性分子誘導下產生的偶極被稱為誘導偶極(induced dipole)。由不斷運動的電子和不停振動的原子核在某一瞬間的相對位移造成分子正負電荷重心分離引起的偶極叫瞬間(instantaneousdipole)。
形成分子力
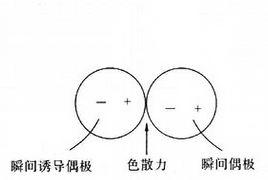
瞬間偶極主要形成的分子間力(即范德華力)為色散力。
色散力(dispersion force)是分子的瞬間偶極與瞬間誘導偶極之間的作用力,也叫倫敦力(London force)。通常情況下非極性分子的正電荷重心與負電荷重心重合,但原子核和電子的運動可導致電荷重心瞬間分離,從而產生瞬間偶極。瞬間偶極又使鄰近的另一非極性分子產生瞬間誘導偶極,兩種偶極出於異極相鄰狀態。
色散力的大小既依賴於分子的大小,也依賴於分子的形狀。如丙烷、正丁烷和正戊烷均為直鏈化合物,色散力隨分子體積的增大而增大.導致沸點按同一順序升高。
色散力不但普遍存在於各類分子之間,而且除極少數強極性分子(如HF,HO)外,大多數分子間力都已色散力為主。
在非極性分子與非極性分子之間只存在著色散力;在極性分子與極性分子之間存在著色散力、誘導力和取向力。取向力、誘導力和色散力的總和通常叫做分子間力,又稱為范德華(Van der Waals)力。其中色散力在各種分子之間都有,而且一般也是最主要的。只有當分子的極性很大時才以取向力為主。而誘導力一般較小,如下圖所示:
 分子間作用能
分子間作用能對物質影響
主要由瞬間偶極產生的色散力為主要作用力的分子間力對物質的影響有以下幾點:
物質的熔點和沸點
分子間力對物質性能的影響是多方面的。液體物質分子間力愈大,氣化熱就愈大,沸點也就愈高;固態物質分子間力愈大,熔化熱就愈大,熔點也愈高。一般而言,結構相似的同系列物質相對分子質量愈大,分子的變形性也就愈大,分子間力愈強,物質的熔點、沸點也愈高。例如稀有氣體、鹵素等,其熔點、沸點是隨相對分子質量的增大而升高的。分子間力對分子晶體的硬度也有一定的影響。極性小的聚乙烯、聚丙烯等物質,分子間力較小,因而硬度不大;而含有極性基團的聚甲基丙烯酸甲酯(俗稱有機玻璃)等,分子間力較大,因而硬度較大。
物質的溶解性
物質在溶劑中的溶解性可以用“相似相溶”的經驗規律來判斷。即極性溶質易溶於極性溶劑;非極性(或弱極性)溶質易溶於非極性溶劑。溶質與溶劑的極性越相似,越易互溶。例如,碘易溶於苯或四氯化碳,而難溶於水。其原因是碘、苯和四氯化碳等都是非極性分子,分子間存在著相似的分子間力(色散力),而水為極性分子,分子之間除存有分子間力之外還有氫鍵,因此碘難溶於水。