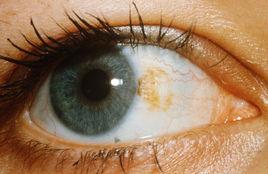
眼色素
眼色素也叫葡萄膜,形似紫色的葡萄而得名,是眼球壁的第二層,可分為前中後3部分,即前部的虹膜,中部的睫狀體和後部的脈絡膜。脈絡膜位於鞏膜和視網膜之間,為葡萄膜面積最大的部分。正常的脈絡膜是一層柔軟光滑而具有一定彈性的棕色薄膜,富含血管和色素,其厚度為0.1毫米~0.2毫米。它猶如照相機上的暗箱,起遮光作用。葡萄膜為眼球壁的中間層,含有豐富的血管與色素,曾有色素膜與血管膜之稱。前葡萄膜包括虹膜與睫狀體,後葡萄膜即脈絡膜;這三部分組織在解剖上緊密聯接,病變時則互相影響。
眼睛壁分為三層,葡萄膜是中間的一層,由於這層膜取出後像一個葡萄,呈紫黑色,又圓又軟,因此叫葡萄膜。由於葡萄膜血流量大、血流速度緩慢,眼球的血液營養由它提供,血液里的致病性抗原物質會在此處沉澱,因此與全身性疾病有密切聯繫,所以是容易發炎的部位之一 。
眼色素上皮細胞的形態學特徵
眼色素上皮細胞排列呈單層,為立方形結構。細胞頂部包含兩種微絨毛:一類細長,約5~7μm,另一類粗短。微絨毛可以擴大表面接觸面積,利於實現經上皮細胞的物質轉運等功能;另一方面,微絨毛延伸到光感受器周圍的間隙,包繞感光細胞外節,吞噬脫落的外節段。眼色素上皮細胞底部也有許多凹陷,以擴大表面積,利於營養物質的轉運。眼色素上皮細胞的側面與毗鄰細胞的胞膜之間有不同寬度的細胞間隙,形成緊密連線,構成血-視網膜屏障。IPE為一單層立方形上皮細胞,其下是基底膜,易與基質分離。核圓,含棕色色素顆粒。IPE頂端有大量微絨毛,胞質中含大量色素、線粒體,部分IPE中含有肌絲,相鄰細胞間可見縫隙連線。IPE與眼色素上皮細胞在形態上極為相似。
眼色素上皮細胞的生理功能特徵
RPE的生理功能主要包括:物質轉運、視黃醛轉運儲存、吞噬降解光感受器外節段、遮光、清除自由基、合成多種細胞因子、構成血-視網膜屏障等。而IPE一直被認為對於視覺形成沒有太大作用,它的作用主要是遮擋光線。但是對體外培養的IPE進行研究時,發現IPE表達了與眼色素上皮細胞類似的功能。
經上皮細胞物質轉運功能
RPE通過胞膜、特殊轉運蛋白、胞間聯接等方式調節、轉運多種離子、營養物質及代謝產物。眼色素上皮細胞通過調控K+、Na+、Cl-、HCO-3等離子的轉運,決定了細胞膜的去極化、水的轉運、pH值的高低。眼色素上皮細胞主動轉運多種胺基酸,例如牛磺酸、丙氨酸、亮氨酸。葡萄糖通過GLUT1受體被動轉運,該受體已經定位於頂端及基側眼色素上皮細胞胞膜上,它的轉運受旁分泌及內分泌等多種因素調節。氣體通過胞膜自由擴散以提供組織足夠的氧。Schraermeyer等研究發現IPE具有Na+-K+-ATP酶活性,Na+-K+-ATP酶是維持鈉、鉀平衡及胺基酸、糖類等物質共同轉運的動力來源,從而得出IPE可能具有物質轉運功能。
生理屏障功能
眼色素上皮細胞的側面與毗鄰細胞的胞膜之間有不同寬度的細胞間隙,形成緊密連線,從而構成血-視網膜屏障。血-視網膜屏障可阻擋大分子通過,保證視網膜各層細胞間質的水、電解質的平衡。睫狀體上皮、IPE通過細胞間的緊密連線和虹膜血管共同構成血-房水屏障。脂溶性物質可以自由擴散透過屏障,而Na+、蛋白質及其它大分子不能透過屏障。Rezai等在半透膜上培養LongEvans鼠的IPE和眼色素上皮細胞,並觀察它們清除白蛋白的情況,發現兩者都能限制白蛋白通過,IPE能發揮和眼色素上皮細胞相似的大分子屏障功能,同時發現IPE單層細胞的相鄰細胞間形成封閉小帶和粘連小帶,正是這種結構使IPE具備了屏障功能,他們認為IPE可能在視網膜下也可以形成緊密連線,代替眼色素上皮細胞發揮血-視網膜屏障功能。
視黃醛轉運和儲存功能維生素A通過眼色素上皮細胞基底或基側胞膜的特異結合位點轉運,進入細胞內,同胞內維生素A結合蛋白結合,並發生酯化反應,轉化為11-順視黃醇,再氧化為11-順視黃醛後進入視桿、視錐細胞,同視蛋白結合生成視紫紅質。在整個循環過程中,眼色素上皮細胞起了轉運作用,並通過酯化反應儲存視黃醛。Herbert等檢測出培養的IPE具有與眼色素上皮細胞一致的維生素A結合蛋白的表達。由於維生素A結合蛋白是維生素A轉運所必不可少的載體,因此,IPE可能同眼色素上皮細胞一樣具有視黃醛轉運和儲存功能。近年來Thumann等發現牛的IPE和眼色素上皮細胞均有視黃醇結合蛋白(CRALBP),視網膜色素上皮膜受體p63(眼色素上皮細胞63)和11-順脫氫酶(11-cisRDH)的mRNA表達。CRALBP和11-cisRDH在兩者中表達的強度相似,IPE中眼色素上皮細胞63表達較眼色素上皮細胞少。由此認為,IPE可能具有視黃醛代謝功能。但是VonRecum發現培養的人IPE只能非特異地將全反視黃醇轉化為13-順視黃醇,而不是轉化為11-順視黃醇,認為IPE無法完成視黃醛代謝功能,這一方面尚待進一步研究。
遮光、清除自由基功能
RPE的遮光、清除自由基作用保證了感光細胞的正常功能。眼色素上皮細胞在代謝過程中過度的氧化反應會造成眼色素上皮細胞損傷,阻止眼色素上皮細胞的氧化損傷主要有三種形式:1.眼色素上皮細胞中的黑色素能削弱光線的波長及強度;2.眼色素上皮細胞可產生多種酶來消除自由基,例如過氧化物歧化酶,過氧化氫酶;3.眼色素上皮細胞可以通過多種非酶途徑消除自由基,例如谷胱甘肽、抗壞血酸、維生素E、類胡蘿蔔素、黑色素等抗氧化劑。通過這些途徑,有效地消除氧自由基,防止視網膜感光細胞遭到破壞。近來研究發現虹膜中也有類胡蘿蔔素、Cu2+/Zn2+超氧化物歧化酶(Cu2+/Zn2+SOD)、酸性谷胱甘肽S-轉移酶(GST)。研究者認為虹膜可能具有一定的抗氧化作用。
眼色素層炎的免疫機制
抗原特異性免疫應答分為細胞免疫和體液免疫應答。兩者均要通過巨噬細胞、樹突狀細胞處理呈遞抗原信息,某些眼組織如視網膜色素上皮細胞也能處理和呈遞抗原。體液免疫應答包括抗原呈遞細胞、CD+4T細胞、B淋巴細胞的互相作用,刺激B細胞增殖分化為抗體形成細胞並分泌Ab。細胞免疫是由抗原呈遞細胞將Ag處理後將其傳遞給CD+4細胞,刺激其增殖,激活的T細胞也能調節其它免疫細胞如巨噬細胞、CTL、NK參與免疫應答。另外,激活的CD+4T細胞歸巢到含有致敏抗原的靶器官,一旦激活的T細胞到達眼部便釋放細胞因子,細胞因子招引其它炎症細胞參與炎症反應,炎性細胞釋放過多的炎症介質如自由基、環氧酶、脂氧酶衍生物、細胞酶和神經肽,這些介質使血管通透性增加,組織變性,進一步加重炎症反應。許多類型的眼色素層炎是針對某些眼組織蛋白,由T細胞介導的免疫應答所致。Wacker及其同事證明皮內注射視網膜提取物能誘導豚鼠產生眼色素層炎。
眼色素層源性Ag簡稱S-Ag,是-50kD蛋白,發現在感光器外層和某些物種的松果體。此後,又有人證明在遠離眼睛的部位注射S-Ag也能誘導多種易感動物如大鼠、兔、豚鼠、靈長類的眼色素層炎。用另外三種抗原:感光器間類視網膜結合蛋白,視紫紅質,恢復蛋白免疫也能誘導眼色素層炎,這種眼內炎性疾病的動物模型稱實驗性自身免疫性眼色素層視網膜炎(EAU)。依所用Ag劑量和動物種類,一般在免疫10~14天后出現症狀,其特點是玻璃體炎,脈絡膜、視網膜浸潤,視網膜血管炎。組織學改變為視網膜感光層變性,脈絡膜、視網膜炎性細胞浸潤,嚴重時視網膜出血和血管炎,免疫組織化學結果顯示EAU早期炎性浸潤細胞以T細胞為主,還有巨噬細胞,這些細胞在疾病的發展中起重要作用。
EAU是研究多種類型人眼色素層炎的動物模型,交感性眼炎是一種針對眼的致敏T細胞介導的眼內炎性疾病。該病是由於一隻眼睛受傷後的幾天至幾年,另一眼也發生炎症反應,其特點是前房肉芽腫性炎症,中度至重度玻璃體炎,脈絡膜浸潤,組織學改變顯示色素層瀰漫性肉芽腫炎症,少量脈絡膜毛細血管炎,上皮細胞內含被吞噬的色素 。
人的交感性眼炎有與鼠、猴EAU相似的臨床症狀和組織學特徵。Marak發現交感性眼炎患者外周血淋巴細胞受視網膜色素上皮和視網膜Ag刺激而增殖,但脈絡膜提取物無此作用。這些資料提示該病是由於眼部受傷使先前隔絕的視網膜Ag釋放所致。交感性眼炎不是唯一一種由T細胞介導所致疾病。眼色素層炎的動物模型不僅有利於對參與這類疾病免疫機制的理解,而且使我們能嘗試用新的方法治療這類疾病。
類固醇仍是治療各種類型眼色素層炎的主要藥物,其作為具有多種藥理作用的免疫抑制劑,對Ag特異性和非特異性的眼色素層炎均有抗炎作用,但影響人體多種組織的生理功能,由於過多的副作用,許多病人不能耐受治療,況且許多自身免疫疾病對類固醇有抵抗,因此,迫切需要尋找新靶進行免疫治療。許多在動物模型中用於控制疾病發生的方法成功地用於人眼色素層炎的治療。
眼色素層炎的免疫治療
環孢素A
因為動物模型的研究和人眼色素層炎的組織學分析均提示:T細胞是導致眼的炎性疾病的主要始動因素。研究者找到了一種針對T細胞的免疫抑制藥,T細胞調節其它效應細胞或歸巢遷移到炎症部位必須先被激活。已證明CsA能通過干擾IL-2的產生封閉參與激活T細胞基因。CsA能抑制EAU的產生,在Lewis鼠每天10mg/kg,能完全防止用S-Ag誘導的EAU,甚至在免疫後一周給予CsA,也有抑制效果。對類固醇和其它免疫抑制劑有抵抗的病人給予相同的有效劑量(10mg/kg.d),臨床初步觀察視覺敏銳有改善,眼內的炎症減輕。此後CsA有效治療許多類型的眼色素炎包括Behctet病。Masuda證明CsA比ColChicine治療Behcet病更有效,Whitcup採用CsA與低—中等劑量的強的松聯合用藥治療Behcet病的效果比單用高劑量CsA要好。
口服耐受
免疫耐受是免疫系統對特異Ag產生的無應答狀態,其產生機制是反應細胞的克隆清除或無能,抑制細胞及其分泌的介質作用。口服耐受是指口服某種Ag後所誘導的免疫耐受狀態。Whitcup給Lewis大鼠口服視網膜S-Ag,結果發現實驗組鼠比對照組鼠EAU的發病率低,用IRBP餵飼大鼠也獲得類似的結果。其它研究者利用口服或鼻腔給予S-Ag也發現有誘導耐受的作用。最近,Whitcup發現新生小鼠免疫耐受可通過接受建立口服耐受鼠的脾細胞建立。不少學者研究了口服耐受的機制,認為自身反應性細胞的克隆清除、克隆無能、分泌TGF-β,IL-4,IL-10的Th2細胞介導的主動抑制可能是口服耐受的主要機制,且發現口服高劑量的自身Ag誘導克隆清除,口服低劑量Ag誘導主動抑制。在動物模型研究的基礎上,Whichy讓兩名眼色素層炎的患者口服S-Ag,發現其有明顯的治療反應,一名患者可完全停止免疫抑制劑的使用,另一患者減少了抑制劑的使用,最近Bethesder完成ⅠⅡ/期隨機臨床實驗。在與全身使用免疫抑制劑的病人作比較時,結果發現,隨機接受口服視網膜S-Ag的病人較接受視網膜多種Ag混合物或安慰劑組的效果更好。
細胞粘附分子療法
鑒於眼色素層炎發病的免疫機制的最後一個環節是白細胞被招引到眼睛,提出了第三種治療方法:細胞粘附分子療法。先前,研究者認為炎性細胞集聚於炎症部位,僅依靠趨化因子的釋放,近10餘年人們知道了一種稱細胞粘附分子的細胞表面蛋白負責白細胞的歸巢並通過血管內皮移出進入炎症部位。招引炎性細胞到達眼睛的三種重要粘附分子是選擇素、整合素、膜Ig超家族。選擇素參與炎性細胞粘附到血管內皮細胞進而穿過血管壁,然後由炎性細胞表達的某些整合素與血管內皮細胞表達的Ig超家族成員互相作用,這種互相作用使細胞牢固結合到血管內皮細胞,促進炎性細胞由細胞內向外移出,並進入炎症組織。已經證明,血管內皮細胞表達粘附分子增加先於炎性細胞遊走到眼部,在EAU的動物模型中,Ag致敏後七天,視網膜血管內皮細胞開始表達細胞間粘附分子-1(ICAM-1),10天后,眼部出現表達白細胞功能相關Ag-1(LFA-1)及ICAM-1受體的炎性細胞,因為ICAM-1表達先於炎性細胞進入眼睛之前,它似乎參與了白細胞的歸巢和移動 。