簡介
 熱休克蛋白
熱休克蛋白熱休克蛋白(HSPs)是廣泛存在於生物界從原核到真核細胞中的一類具有高度保守性的蛋白質,當細胞在受到某些不利因素(如高熱、感染、缺血、缺氧及化學物質等)刺激時,會迅速短暫地大量合成,並通過與細胞內部分變性的蛋白質結合,協助其復性或將其運送至溶酶體降解而發揮細胞保護功能,因而可以認為應激時HSPs在細胞內的出現標誌著細胞自身保護機制的啟動。
熱休克蛋白依據其分子質量而命名。例如,Hsp60、Hsp70與Hsp90(被研究最多的熱休克蛋白)指的是熱休克蛋白家族的質量分別大約為60、70與90千道爾頓。另有一種8千道爾頓的蛋白泛素,這種蛋白用於標記即將分解的蛋白質,也表現出熱休克蛋白的性質。
產生
熱休克蛋白是一種在能對細胞產生損傷的在多種外在刺激下產生的應激蛋白。
義大利生物學家里多薩於1962年在研究果蠅的發育時最早發現了熱休克現象。
20世紀70年代,科學家進一步發現,細胞在遭受高於正常溫度的刺激時,都會大量合成這種蛋白。當遭遇高溫或外在的不良刺激時,其他很多蛋白合成都會受到抑制,而讓開道路優先合成熱休克蛋白。它們在體內有很多重要的作用,最主要的是以“分子伴侶”的身份出現的,顧名思義,就是幫助穩定蛋白質和多肽,當蛋白質發生錯誤後使之恢復正常,還能降解嚴重損傷的蛋白質。
特性
普遍性:熱休克蛋白能對抗嚴重的應激損傷,這種現象稱為熱休克反應(heatshockresponse,HSP),熱休克反應廣泛存在於從原核到真核生物的生物界有機體內。
保守性:熱休克反應是存在於生物系統不同層次結構中的普遍現象,產生的熱休克蛋白從結構到功能都具有極端的保守性,其核酸序列在不同物種之間具有高度的同源性,如大腸桿菌的DnaK基因與真核生物HSP70基因有40%-60%的同源性,真核生物間HSPs的同源性可達60%-80%。
不僅能為熱損傷所誘導,而且可謂許多其它損傷因素及應激刺激,包括物理、化學因素乃至機械刺激(如葡萄糖缺乏、缺血、寒冷、創傷、中毒、重金屬、飢餓、缺氧、氧自由基)所誘導,以及其它因素如感染(包括細菌、病毒和寄生蟲感染)、惡性腫瘤等所誘導。
隨著年齡地增加,熱休克蛋白的數量和質量都明顯地減少。結果導致形成不活動的、不成形的蛋白質,它們不能支援皮膚。這樣慢慢老化,當皮膚的結構紊亂時,皮膚就會不再健壯。
功能作用
提高耐熱能力
預先給生物以非致死性的熱剌激,可以加強生物對第二次熱剌激的抵抗力,提高生物對致死性熱剌激的存活率,這種現象稱為熱耐受。目前對此現象的分子機制仍不太清楚,但許多研究均發現了熱休克蛋白的生成量與熱耐受呈正相關。
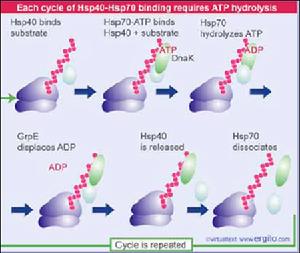 熱休克蛋白(Hsp70)協助蛋白質摺疊的循環過程
熱休克蛋白(Hsp70)協助蛋白質摺疊的循環過程調節Na+ -K+ -ATP酶的活性
某些細胞經熱休克喪失的Na+ -K+ -ATP酶活性可在3℃培養中隨著熱休克蛋白的產生而得到部分恢復。熱休克蛋白的誘導劑亞砷酸鈉亦可使Na+ -K+ -ATP酶的活性升高。這種現象可被放線菌素D和環己醯亞胺抑制,提示Na+ -K+ -ATP酶活性升高是一種基因表達的結果,而不是亞砷酸鈉直接作用的結果。
提高應能力
有人通過四膜蟲屬細胞熱休克的研究,發現有些熱休克蛋白具有促進細胞內糖原異生和糖原生成的作用,使細胞內糖原貯量增多,從而提高應能力。
增強對損傷的抵抗力
熱、乙醇、亞砷酸鈉的預處理不僅能使某些細胞產生熱耐受,還能使細胞對阿黴素(adriamycin)的耐受性增強,提示熱休克蛋白可以增強對各種損傷的抵抗力。
紫外線照射會造成骨膠原流失,是產生皺紋的重要原因。然而若用相當於體溫的37攝氏度溫水熱敷實驗鼠,其後背會出現明顯皺紋,若用42攝氏度溫水熱敷,就不會產生皺紋。原因可能是身體暴露於高溫時會合成一種熱休克蛋白自我保護。研究證明,通過泡澡和熱敷的方式可以預防皺紋產生。
套用
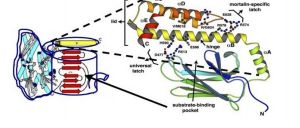 熱休克蛋白
熱休克蛋白在不利的環境中,各種有機體都有其共同對應的分子反應,即正常基因的表達抑制和一組特殊基因,熱休克基因的激活和表達,導致熱休克蛋白的大量產生,熱休克蛋白主要作為分子伴侶而參與蛋白質的摺疊、轉運及組裝等過程,能恢復或加速清除細胞內已變性的蛋白質而穩定細胞結構,細胞產生熱耐受。隨著對熱休克蛋白研究的不斷深入,該蛋白質在生物工程和醫學等方面的套用前景十分廣闊。