物理性質
 氮化鎂樣品
氮化鎂樣品氮化鎂(MgN)是由氮和鎂所組成的無機化合物,立方晶系。在室溫純淨的氮化鎂下為黃綠色的粉末,但含有一部分氧化鎂雜質的氮化鎂是灰白色的。 能溶於酸,微溶於乙醇和乙醚。
化學性質
氮化鎂和許多金屬氮化物一樣,會和水反應產生氨。
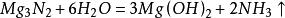 氮化鎂
氮化鎂與酸或含水的非金屬氧化物反應,生成銨鹽和鎂鹽。
主要用途
1、製備高硬度、高熱導、抗腐蝕、抗磨損和耐高溫的其它元素的氮化物時作為催化劑。第一次成功合成立方氮化硼時,使用的催化劑就是氮化鎂;
2、用於高強度鋼冶煉的添加劑。氮化鎂(MgN)替代建築鋼材冶煉中的脫硫鎂,有利的提高鋼材的密度、強度、拉力及承受力。另外使用氮化鎂(MgN)脫硫,可以適量減少其他添加劑,從而有助於降低建築鋼材的生產成本;
3、製備特殊的陶瓷材料;
4、製造特殊的合金的發泡劑;
5、用於製造特種玻璃;
6、催化聚合物交連;
7、核廢料的回收;
8、用於人造金剛石合成的觸媒及立方氮化硼的觸媒材料。
製備方法
要製備氮化鎂,可將鎂帶在氮氣中燃燒而成。其反應方程式為:
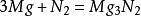 氮化鎂
氮化鎂以上反應如果氮氣不純則易生成含氧化鎂的產品。在乾燥的NH氣體中反應的方法就更好些。
將鎂屑置於瓷舟或燒結氧化鎂舟中,舟裝在瓷管中,瓷管一端連線T形管,T形管一端可通入乾燥的氨氣,另一端可通入氮氣。瓷管末端連線U形管,管中裝有乾燥劑,一半是小片狀的CaO,另一半是小片狀的KOH。反應管排出的氣體被吸收裝置吸收,吸收裝置是兩個盛有稀硫酸的錐形瓶。為防止發生倒吸,第一個吸收瓶的導管不要插到稀硫酸液面之下。
向瓷管中通入乾燥的NH和N,至第二個吸收瓶不再冒出氣泡時,說明瓷管內空氣已經趕淨。升溫至800~850℃,加熱鎂粉4h,鎂粉變得熾熱,標誌著反應的開始,與此同時必有H產生。反應過程中NH3的氣壓要大於外界大氣壓,以免倒吸。反應結束,關閉NH,保持原來的溫度繼續通N 1.5h,以除去被吸附在MgN上的NH·MgN極易潮解,必須保存在乾燥的容器中。
若將鎂帶在空氣中燃燒,除了會產生氧化鎂之外,也會產生一些氮化鎂。
存儲運輸
因為氮化鎂容易與水(HO)化合分解,因此需要真空密封保存,防水、防潮。
對水體是稍微有害,不要將未稀釋或大量產品接觸地下水,水道或污水系統,未經政府許可勿將材料排入周圍環境。
安全信息
危險運輸編碼:UN 2813 4.3/PG 1
危險品標誌:刺激
安全標識:S26S36
危險標識:R36/37/38
計算化學數據
1、 氫鍵供體數量:0
2、 氫鍵受體數量:2
3、 可鏇轉化學鍵數量:0
4、 拓撲分子極性表面積(TPSA):2
5、 重原子數量:5
6、 表面電荷:0
7、 複雜度:8.9
8、 同位素原子數量:0
9、 確定原子立構中心數量: 0
10、 不確定原子立構中心數量:0
11、 確定化學鍵立構中心數量:0
12、 不確定化學鍵立構中心數量:0
13、 共價鍵單元數量:2

