氫原子波爾模型的研究歷史
20世紀初期,德國物理學家普朗克為解釋黑體輻射現象,提出了量子論,揭開了量子物理學的序幕。19世紀末,瑞士數學教師巴耳末將氫原子的譜線表示成巴耳末公式,瑞典物理學家裡德伯總結出更為普遍的光譜線公式里德伯公式。然而巴耳末公式和里德伯公式都是經驗公式,人們並不了解它們的物理含義。
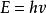 氫原子波爾模型
氫原子波爾模型1905年,瑞士著名物理學家A Einstein對光電效應作成功解釋時,提出了光子論,他認為一束光由具有離子特徵的光子所組成,每一個光子的能量與它的頻率成正比,即 ;h是普朗克常量。在光電效應試驗中,具有一定頻率的光子和電子碰撞時,將能量傳給電子;光子的能量越大,電子得到的能量也越大,發射出來的光電子能量也越大。
1911年,英國物理學家盧瑟福根據1910年進行的α粒子散射實驗,提出了原子結構的行星模型。在這個模型里,電子像太陽系的行星圍繞太陽轉一樣圍繞著原子核旋轉。但是根據經典電磁理論,這樣的電子會發射出電磁輻射,損失能量,以至瞬間坍縮到原子核里。這與實際情況不符,盧瑟福無法解釋這個矛盾。
1912年,正在英國曼徹斯特大學工作的玻爾將一份被後人稱作《盧瑟福備忘錄》的論文提綱提交給他的導師盧瑟福。在這份提綱中,玻爾在行星模型的基礎上引入了普朗克的量子概念,認為原子中的電子處在一系列分立的穩態上。回到丹麥後玻爾急於將這些思想整理成論文,可是進展不大。
1913年2月4日前後的某一天,玻爾的同事漢森拜訪他,提到了1885年瑞士數學教師巴耳末的工作以及巴耳末公式,玻爾頓時受到啟發。後來他回憶到“就在我看到巴耳末公式的那一瞬間,突然一切都清楚了,”“就像是七巧板遊戲中的最後一塊。”這件事被稱為玻爾的“二月轉變”。終於,波爾在基於對金屬的電子理論和射線穿透能力的研究,引用了能量量子化作為原子穩定的要素,成功解釋了氫原子光譜。
1913年7月、9月、11月,經由盧瑟福推薦,《哲學雜誌》接連刊載了玻爾的三篇論文,標誌著玻爾模型正式提出。這三篇論文成為物理學史上的經典,被稱為玻爾模型的“三部曲”。
波爾氫原子理論的要點
(1) 定態假設 原子的核外電子在軌道上運行時,只能夠穩定地存在於具有分立的、固定能量的狀態中,這些狀態稱為定態(能級),即處於定態的原子能量是量子化的。此時,原子並不輻射能量,是穩定的。
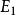 氫原子波爾模型
氫原子波爾模型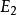 氫原子波爾模型
氫原子波爾模型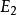 氫原子波爾模型
氫原子波爾模型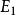 氫原子波爾模型
氫原子波爾模型(2) 躍遷規則 原子的能量變化(包括發射或吸收電磁輻射)只能在兩定之間以躍遷的方式進行。在正常情況下,原子中的電子儘可能處在離核最低的軌道上。這時原子的能量最低,即原子處於基態,當原子受到輻射、加熱或通電時,獲得能量後電子可以躍遷到離核較遠的軌道上去,即電子被激發到高能量的 軌道上,這時原子處於激發態。處於激發態的電子不穩定,可以躍遷到離核較近 的軌道上,同時釋放出光子。光的頻率v取決於離核較遠的軌道的能量( )與 離核較近軌道的能量( )之差: hv= -
波爾模型對於實驗氫原子光譜的解釋
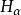 氫原子波爾模型
氫原子波爾模型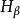 氫原子波爾模型
氫原子波爾模型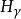 氫原子波爾模型
氫原子波爾模型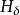 氫原子波爾模型
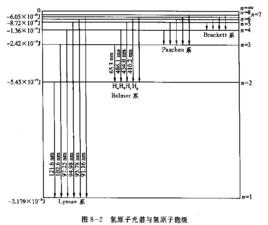
氫原子波爾模型氫原子在正常情況下,電子處於基態,不會發光。當氫原子受到放電等能里激發 時,電子由基態躍遷到激發態。但處於激發態的電子是不穩定的,它可以自發地回到能量較低的軌道,並以光子的形式釋放出能量。因為兩個軌道即兩個能級間的能童差是確定的,所以發射出來的射線有確定的頻率。如可見光譜,即 Balmer線系,就是電子從n=3,4,5.6...能級躍遷到n=2能級時所放出的輻射,其中紅線 是由n= 3能級躍遷到n= 2能級時放出的;青線 ,藍紫線和紫線分別是由n=4,5和6能級躍遷到n=2能級時放出的。總之,因為能級是不連續的,即量子化的,造成氫原子光譜是不連續的線狀光譜,各譜線有各自的頻率值。
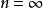 氫原子波爾模型
氫原子波爾模型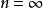 氫原子波爾模型
氫原子波爾模型前面提到,離核最近的電子處於低能級,吸收能量可以躍遷至高能級,如果吸收了足夠的能量可以離開原子(原子電離),可認為該電子處於離核無窮遠的能級,即 。離開原子的電子與核之間不再有吸引作用,因此,相對於核而言核電子能量是零。氫原子其他 比低的能級,能量皆低於零,均為負值。
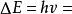 氫原子波爾模型
氫原子波爾模型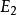 氫原子波爾模型
氫原子波爾模型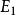 氫原子波爾模型
氫原子波爾模型氫原子光譜中各能級的能量關係式為 -
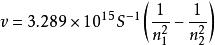 氫原子波爾模型
氫原子波爾模型普遍性的氫原子光譜的頻率公式為:
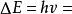 氫原子波爾模型
氫原子波爾模型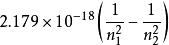 氫原子波爾模型
氫原子波爾模型代入簡化為:
 氫原子波爾模型
氫原子波爾模型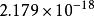 氫原子波爾模型
氫原子波爾模型 氫原子波爾模型
氫原子波爾模型式子中的被稱為常量。
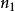 氫原子波爾模型
氫原子波爾模型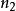 氫原子波爾模型
氫原子波爾模型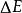 氫原子波爾模型
氫原子波爾模型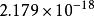 氫原子波爾模型
氫原子波爾模型當=1,為無窮時, =,這就是氫原子的電離能。
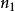 氫原子波爾模型
氫原子波爾模型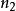 氫原子波爾模型
氫原子波爾模型當=1,2....n,為無窮時,可以計算出氫原子各能級的能量。
Bohr理論成功地闡釋了原子的穩定性、氫原子光譜的產生和不連續性。
實驗驗證
編輯
1897年,美國天文學家皮克林在恆星弧矢增二十二的光譜中發現了一組獨特的線系,稱為皮克林線系。皮克林線系中有一些譜線靠近巴耳末線系,但又不完全重合,另外有一些譜線位於巴耳末線系兩臨近譜線之間。起初皮克林線系被認為是氫的譜線,然而玻爾提出皮克林線系是類氫離子He+發出的譜線。隨後英國物理學家埃萬斯在實驗室中觀察了He+的光譜,證實玻爾的判斷完全正確。
和玻爾提出玻爾模型幾乎同一時期,英國物理學家亨利·莫斯萊測定了多種元素的X射線標識譜線,發現它們具有確定的規律性,並得到了經驗公式——莫塞萊公式。莫塞萊看到玻爾的論文,立刻發現這個經驗公式可以由玻爾模型導出,為玻爾模型提供了有力的證據。
1914年,夫蘭克和赫茲進行了用電子轟擊汞蒸汽的實驗,即夫蘭克-赫茲實驗。實驗結果顯示,汞原子內確實存在能量為4.9eV的量子態。1920年代,夫蘭克和赫茲又繼續改進實驗裝置,發現了汞原子內部更多的量子態,有力地證實了玻爾模型的正確性。
1932年尤雷(H.C.Urey)觀察到了氫的同位素氘的光譜,測量到了氘的里德伯常數,和玻爾模型的預言符合得很好。
波爾氫原子結構模型的重大意義和局限性
Bohr的原子結構量子論,開啟了人們正確認識原子結構的大門。由於他在 庳子理論和原子輻射方囪做出的卓越貢獻,獲得丁 1922年的物理學Nobel獎。 玻爾的原子理論第一次將量子觀念引入原子領域,提出了定態和躍遷的概念,成功地解釋了氫原子光譜的實驗規律。Bohr所提出的概念如量子化、能級和電子躍遷等,至今仍被廣泛採用。
然而, Bohr的量子論畢竟是建立在經典物理學的基礎上,存在問題和局限性是難以避免的。對氫原子光譜的精細結構無法解釋,Bohr假改的平面軌道與電子圍繞原子核呈球形對稱的現象也不符合等.。
實際上,原子中電子的坐標沒有確定的值。因此,我們只能說某時刻電子在某點附近單位體積內出現的機率是多少,而不能把電子的運動看做一個具有確定坐標的質點的軌道運動。(測不準原理)
當原子處於不同狀態時,電子在各處出現的機率是不一樣的。如果用疏密不同的點表示電子在各個位置出現的機率,畫出圖來,就像雲霧一樣,可以形象地把它稱作電子云。
Bohr理論被人們劃定為舊量子論。新量子力學就是在解決舊量子論問題的過程中,繼承和發展了物理學的新成果,向人們展示了原子結構的真實面貌。