氣體簡介
 氣體反應
氣體反應gas reaction氣體反應定律:1809年,法國科學家蓋·呂薩克發現,在氣體的化學反應中,在同溫同壓下參與反應的氣體的體積成簡單的整數比;如果生成物也是氣體,它的體積也和參加反應氣體的體積成簡單的整數比。例如,兩公升的氫和一公升的氧化合時,生成兩公升的水蒸汽。
理想氣體
若某反應 aA(g)+dD(g)→gG(g)+hH(g)
是混合理想氣體的反應,因其組成可分別用分壓pB、濃度CB或物質的量分數xB表示,故有三種不同的“標準平衡常數”表達式Kp、Kc、Kx:
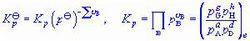 氣體反應
氣體反應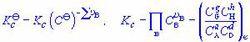 氣體反應
氣體反應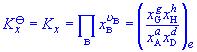 氣體反應
氣體反應式(6-23)Kp為經驗平衡常數,一般有量綱,唯當
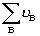 氣體反應
氣體反應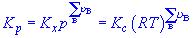 氣體反應
氣體反應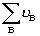 氣體反應
氣體反應=0時才是無量綱量。因為各組分分壓(pB)與體系總壓(p)和濃度(CB)的關係分別為pB=xBp及pB=CBRT,以此分別代入式(6-24)和(6-25)即可建立上述三種平衡常數之間聯繫式: 式中 為產物與反應物的計量係數差。
由式(6-17),因
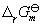 氣體反應
氣體反應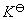 氣體反應
氣體反應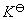 氣體反應
氣體反應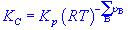 氣體反應
氣體反應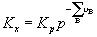 氣體反應
氣體反應可知Kc亦僅為溫度的函式,即KC(T)。而,其值與溫度和體系的總壓有關,故Kx為溫度和壓力的函式,可寫為Kx(T.p)。
水蒸汽
量分數
蓋·呂薩克
理想氣體

