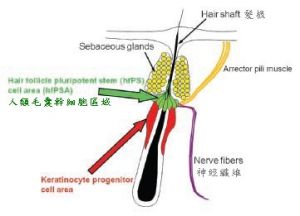
定義
毛囊幹細胞是在人的毛囊外根鞘隆突部中的一種多能性細胞。毛囊幹細胞屬於成體幹細胞,具有慢周期性,在體內處於靜止狀態,在體內培養活內環境作用下表現出驚人的增殖能力。研究發現,毛囊幹細胞具有多向分化潛能,它可以分化成表皮、毛囊、皮脂腺,參與皮膚創傷癒合的過程。 毛囊結構
毛囊結構生物學特性
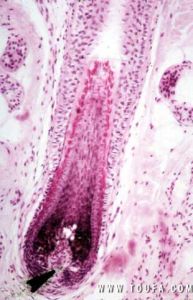 毛囊微觀結構
毛囊微觀結構毛囊幹細胞最重要的特點之一就是慢周期性,而且可以有無限多次細胞周期。當暴露於帶有核素活其他標記的核苷酸時,細胞在DNA合成的過程中攝取標記核苷酸而將標記整合到DNA中。由於幹細胞的細胞周期長,這樣的標記可以維持相當長一段時間。正是由於幹細胞的這一特點,有人便將它稱為標記滯留細胞(label-retainingcells,LRCs)。
實驗證實,LRCs具有幹細胞的特徵:其超微結構及生化特徵方面均具有分化細胞的特點,體積小,細胞器少,克隆形成能力高,細胞周期慢,無限次分裂。之前,研究者通過這種方法已經將成體毛囊幹細胞定位於隆突部。從形態學上看,隆突細胞體積小,有捲曲核,透射電鏡檢查發現其胞漿充滿核糖體,而且缺乏聚集的角蛋白絲,細胞表面有大量微絨毛,是典型的未分化或“原始狀”細胞。其他實驗還證實,毛囊上部角質形成細胞比下部細胞的體外增殖能力強,生存期長。同時,隆突部的細胞體外培養時克隆形成能力也最強。
分化潛能
 德國科學家利用幹細胞技術成功培育出毛囊
德國科學家利用幹細胞技術成功培育出毛囊信號調控
在毛囊幹細胞信號調控中涉及到許多的調控信號,主要包括WNT信號、BMP信號和NFATc1等基因的作用。
WNT信號通路在調節毛囊幹細胞增殖和命運決定中起重要作用,它在毛囊循環的過程中呈一種動態變化,在生長期活性最高。研究均證明WNT信號在毛囊形態發生的調節中和皮膚重建的過程中通過幫助HF世系和與上皮細胞命運有關的祖細胞分化而起作用。
骨形成蛋白信號(BMP)也在毛囊形態發生、出生後的重建和通過調節毛髮基質前體細胞的分化和增殖來控制毛囊循環中起到重要作用。通過異位表達BMP4或特定的缺失BMP拮抗者noggin而增強的BMP信號將導致毛囊生長延遲和越來越嚴重的光禿。表達noggin將誘導毛囊向生長期的過渡,並且破壞毛乾的分化。
WNT信號與BMP信號是一種相互依賴並相互拮抗的關係。在毛髮生長期早期,WNT信號的表達使毛囊幹細胞發生增殖和分化,從而引起表皮相關成分的形成;但是此階段過後,BMP信號中的轉錄因子表達量升高,抑制正在進行增殖分化的幹細胞,從而維持幹細胞巢中的幹細胞數量。
另外,NFATc1基因在毛囊信號調控中也有著重要的作用。
總之,影響毛囊幹細胞增殖、分化的信號通路主要有wm、BMP、notch等。在體外培養狀態下,BMP可使毛囊bulge幹細胞從細胞周期的進程中退出,進而抑制其增殖。
毛囊幹細胞與組織修復重建
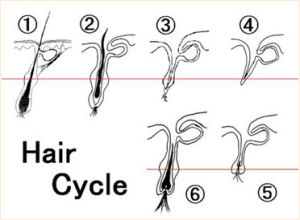 毛髮生長更新
毛髮生長更新毛囊幹細胞在表皮創傷修復中的作用長期以來受到研究者的關注。數十年來,人們利用小鼠和兔進行了大量的研究。在臨床上人們也意識到來自毛囊的角質形成細胞可促進創傷的再生。而有關毛囊幹細胞在表皮創傷後組織的修復、重建中的作用,在後來的相關研究中也得到了證實。有研究結果顯示,在各種皮膚創傷後,bulge區毛囊幹細胞可遷移至表皮。並且,在新生的表皮中,至少有25%的細胞來源於毛囊幹細胞。但與預期有出入的是,在新生的表皮中,其他大多數細胞在幾周后被清除,表明在表皮創傷過程中,毛囊幹細胞參與了創傷的急性修復過程,通過產生短期存在的過渡性放大細胞(TA細胞),對表皮創傷進行快速的回應。
毛囊幹細胞的分離培養
 科學家在顯微鏡下分離鑑定毛囊幹細胞
科學家在顯微鏡下分離鑑定毛囊幹細胞毛髮的周期性自我更新以及生長依賴於毛囊幹細胞(hairfolliclestemcells,HFSCs)周期性增殖和分化。目前研究認為HFSCs定位於毛囊外根鞘的隆突區,大致是毛囊外根鞘最外層靠近立毛肌附著點處。研究HFSCs對於禿髮的發病機制、毛囊組織工程以及幹細胞或基因治療禿髮方面均有重要理論和臨床意義。
有關毛囊幹細胞分離培養的研究,目前在多數實驗室中以鼠的觸鬚毛囊、外科獲取的人頭皮樣本為毛囊幹細胞的組織來源。樣本經中性蛋白酶(dispaseII)處理,分離去除表皮,或者用胰酶/EDTA處理收集的毛囊組織,貨的單細胞懸液培養毛囊幹細胞。人毛囊幹細胞的分離較為困難,因為人毛囊bulge區沒有明確的形態學特徵,外根鞘隆起不明顯”。其次,人毛囊幹細胞缺乏特異的毛囊乾細胞標記物。
人們利用成人枕、顳部的全層頭皮,用顯微切割方法分離出人毛囊bulge區,對分離的細胞進行CD200免疫螢光標記後,用磁珠分選的方法獲得了高純度的人毛囊幹細胞。Kloepper等發現以CD200、K19作為陽性標記物,CD34、nestin為陰性標記物,可以更好地鑑定人毛囊幹細胞,提示在利用於細胞標記物進行毛囊幹細胞分離時,將陽性標記物與陰性標記物加以組合,分離的效果更為有效及實用。
有人套用CD200、frizzled受體、CD34、CD71、CDl46等一系列陽性及陰性標記物,對人毛囊bulge區進行免疫螢光標記後,為了最大數量地獲得毛囊bulge幹細胞,他們又對毛囊bulge區進行了不同於傳統的橫向切片,然後用雷射顯微切割法分離切片中的bulge區,得到了數量眾多的、標記物表達特徵為CD200hiCD24loCD34loCD7lloCDl46lo、具有高克隆形成率及多向分化潛能的人毛囊幹細胞。
毛囊幹細胞的潛在套用
目前,雖然毛囊幹細胞的相關研究還處於實驗室階段,但現有的研究成果預示其將具有廣泛的套用前景。
1)創傷修復與上皮再生中的套用。
2)用於治癒神經損傷。
3)可以作為藥物治療或基因治療的靶點。
4)用於研究皮膚細胞癌變機理和新藥物的篩選。
毛囊幹細胞研究新進展及臨床套用
目前,人表皮幹細胞在體外合適的條件下培養,可製備成表皮片,用於燒傷、慢性創面及潰瘍面的表皮再生治療,這一技術可為創面提供有效的暫時覆蓋,降低感染機會,但這種自體表皮片很脆,不能很好地粘附於創面上,同時在體外培養表皮片非常耗時。近年來,越來越多的研究表明,毛囊幹細胞可培養出表皮的膜片,供給豐富,損傷小,不造成創面,無免疫排異反應,並可實現個體化治療,可為臨床皮膚缺損的修復開闢新的領域和提供更多的選擇方法。通過毛囊幹細胞可以製備皮膚替代物,移植到深度燒傷創面以形成表皮,從而克服目前皮膚移植修復的薄易破、彈性差、功能恢復不全等特點。
從成年生長期毛囊分離出的毛乳頭放於表皮附近可誘導形成新的毛囊。實驗員分離出鼠毛囊隆突部位細胞用飼養細胞一起克隆增殖,再與新生真皮細胞一起,可誘導形成新的組織工程毛囊,從而為脫髮治療新的、較目前最先進也最常用的FUE植髮技術更加高明的方法發明出來,打下了堅固的理論基礎。
斑禿髮病由於大多數毛囊生長初期受抑制,可用基因轉染方法將編碼抗炎症細胞或其它免疫調節劑的基因導入毛囊幹細胞,使毛囊免受免疫攻擊從而起到治療作用,因此,毛囊幹細胞可作為基因治療的介質。毛囊幹細胞在體外合適條件下培養可誘導形成表皮及新的毛囊,從而為脫髮、斑禿修復以及燒傷、燙傷造成的疤痕治療帶來新的希望。
綜上所述,研究毛囊幹細胞如何增殖與分化調控機制,不但有實現以毛囊幹細胞作為種子細胞構建組織工程化皮膚及毛囊,來分別治療皮膚缺損和脫髮的重大意義,而且也為治療某些棘手的皮膚病、毛囊疾病帶來了希望。