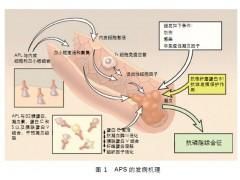
病因
由於在APL陽性的人群中只有部分患者出現臨床表現,故APS的發生還與其他因素有關。有研究提示這些抗體可抑制由帶有陰性電荷磷脂催化的凝血瀑布反應。這些反應包括因子X的激活,凝血酶原-凝血酶的轉換,蛋白C的激活,以及激活的蛋白C所致的因子Va的失活。APL抑制蛋白C激活或者中和對因子Va失活的作用,可使病人處於“血栓前狀態”。已經證明抗心磷脂抗體(ACL)與磷脂醯絲氨酸的交叉反應使之與血小板結合併激活血小板,也可引起血栓形成。其他可能的機理還包括血小板合成的血栓素增加,抑制前列腺環素的合成,以及刺激由內皮細胞產生組織因子。
在APL介導的血栓形成過程中,一種名為β糖蛋白1(βGP1)的血漿蛋白很受關注。目前認為APL可通過中和βGP1的抗凝作用引起血栓形成。
自身免疫性APL通過結合βGP1或其他磷脂結合蛋白而與帶負電荷的磷脂結合,為βGP1依賴性APL。然而,梅毒、非梅毒螺鏇體、伯氏疏螺鏇體、人類免疫缺陷病毒(HIV)、鉤端螺鏇體及寄生蟲等感染,以及藥物和惡性腫瘤誘導形成的抗磷脂抗體通常能與磷脂直接結合,為βGP1非依賴性抗體。
臨床表現
APS的臨床表現從無症狀APL陽性(無血栓史或病態妊娠史)到惡性APS(數天內發生廣泛血栓),程度不一。
1.血管栓塞
可以出現任何組織或器官的動、靜脈和小血管血栓。常常發生在少見部位、發病年齡輕、反覆發作。
2.流產
典型的APS患者流產多發生在妊娠的10周以後,但也有早於10周者,後者更多見於染色體或其他基因缺陷。APS患者早期3個月妊娠多正常,以後發生胎兒生長緩慢和羊水減少,還可出現子癇和先兆子癇。
3.非特異性表現
網狀青斑、血小板減少、自身免疫性溶血性貧血、心臟瓣膜病(瓣膜贅生物或增厚)、瀰漫肺泡出血、肺動脈高壓、多發性硬化樣綜合徵、舞蹈症或其他脊髓病等。
4.惡性抗磷脂綜合徵(CAPS)
這是一種罕見的突發的威脅生命的併發症,於數天內出現中、小動脈廣泛血栓(儘管使用了足量抗凝治療),引起腦卒中,心臟、肝、腎上腺、腎和腸梗死,以及外周組織壞疽。
檢查
狼瘡抗凝物、ACL、或抗β2GP1抗體陽性,有助於確診。
診斷
2004年修訂的APS分類診斷標準(Sapporo):
1.臨床標準
(1)血管栓塞 任何組織或器官的動、靜脈和小血管發生血栓≥1次。
(2)異常妊娠
1)≥1次發生於妊娠10周或10周以上無法解釋的形態學正常的胎兒死亡,或2)≥1次發生於妊娠34周之前因嚴重的先兆子癇、子癇或者明確的胎盤功能不全所致的形態學正常的新生兒早產,或3)≥3次發生於妊娠10周之前的無法解釋的自發性流產,必須排除母體解剖或激素異常以及雙親染色體異常。
2.實驗室標準
(1)狼瘡抗凝物至少2次陽性,間隔至少12周。
(2)中/高滴度IgG/IgM型ACL至少檢測2次,間隔至少12周。
(3)IgG/IgM型抗β2GP1抗體至少檢測2次,間隔至少12周。
診斷APS必須符合至少1項臨床標準和1項實驗室標準。
| APL持續陽性的治療建議 | |
| 臨床表現 | 建議 |
| 無症狀 | 不治療或阿司匹林(81mg/d) |
| 靜脈血栓形成 | 華法林INR2.5不確定 |
| 動脈血栓形成 | 華法林INR2.5不確定 |
| 反覆血栓形成 | 華法林INR3~4 +小劑量阿司匹林 |
| 妊娠 | |
| 初次妊娠 | 不治療或阿司匹林(81mg/d) |
| 1次流產(<10周) | 不治療或阿司匹林(81mg/d) |
| ≥1次胎兒丟失或 ≥3次流產,無血栓形成 | 妊娠全程預防性肝素+小劑量阿司匹林,至產後6~12周 |
| 血栓,不論有無妊娠史 | 妊娠全程預防性肝素或小劑量阿司匹林,產後華法林 |
| 瓣膜贅生物或者畸形 | 無有效治療。如有栓子或心內血栓證據則全身抗凝 |
| 血小板減少(>50000/mm) | 不治療 |
| 血小板減少(<50000/mm) | 潑尼松,靜脈注射免疫球蛋白 |
| 惡性抗磷脂綜合徵 | 抗凝+糖皮質激素+靜脈注射免疫球蛋 白或血漿置換 |
預後
原發性APS患者長期預後較差。肺動脈高壓、神經病變、心肌缺血、腎病、肢體壞疽和惡性抗磷脂綜合徵患者預後較差。
儘管已經進行預防,APS患者仍可能發生嚴重圍手術期併發症,因為手術時發生血栓的危險增加。因此在任何手術前均應制定明確的應對策略,採取藥物學和物理學的抗凝措施,儘量減少無抗凝的時間,儘量減少血管內操作和檢測。