簡介
1906年,德國化學家奈斯特(Nernst,W.)研究化學反應在低溫下的性質時得到一個結論:
任何凝聚系在等溫過程中的△G和△H隨溫度的降低是以漸近的方式趨於相等,並在0K時兩者不但相互會合,而且共切於同一水平線,這就是奈斯特熱定理。
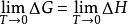 奈斯特熱定理
奈斯特熱定理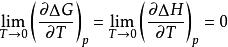 奈斯特熱定理
奈斯特熱定理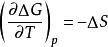 奈斯特熱定理
奈斯特熱定理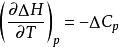 奈斯特熱定理
奈斯特熱定理奈斯特熱定理的適用範圍
奈斯特熱定理在低溫下,不僅適用於穩定平衡狀態,也適用於亞穩的平衡態。不僅適用於有序構型,也適用於無序類型。
奈斯特假設
“凝聚相體系在等溫過程的熵變,隨熱力學溫度而趨於零”
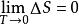 奈斯特熱定理
奈斯特熱定理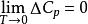 奈斯特熱定理
奈斯特熱定理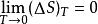 奈斯特熱定理
奈斯特熱定理奈斯特熱定理,也稱為熱力學第三定律。
奈斯特熱定理的重要推論
解釋Richards實驗結果及Thomson-Berthelot原則(用判斷化學反應的方向性的原則)
(1)等溫過程中的△G和△H在T→0時彼此相等
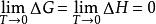 奈斯特熱定理
奈斯特熱定理即
說明在T→0等溫過程中△G和△H是等價的。
(2)等溫過程中的△Cp隨熱力學溫度同趨於零
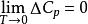 奈斯特熱定理
奈斯特熱定理(3)物質的Cp和CV隨熱力學溫度同趨於零
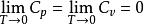 奈斯特熱定理
奈斯特熱定理(4)下列四個關係是正確的
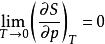 奈斯特熱定理
奈斯特熱定理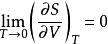 奈斯特熱定理
奈斯特熱定理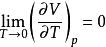 奈斯特熱定理
奈斯特熱定理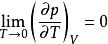 奈斯特熱定理
奈斯特熱定理