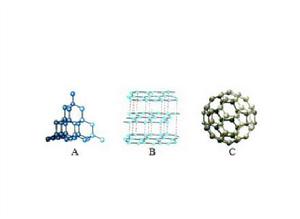
概念
由同種元素組成的具有不同性質的單質互為同素異形體。某些同素異形體可以相互轉化。如紅磷可以轉變成白磷,石墨可以轉變成金剛石,菱形硫可以轉變成單斜硫等。
在物理變化中因無新物質生成故無化學鍵的破裂和生成,在化學變化中因有新物質生成故一定有化學鍵的破裂和生成。因此判斷同素異形變化是物理變化,還是化學變化,一定要從同素異形體的結構上分析,看在轉變中有無化學鍵的破裂和生成。
同素異形變化區分
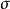 同素異形變化
同素異形變化 同素異形變化
同素異形變化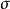 同素異形變化
同素異形變化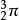 同素異形變化
同素異形變化形成同素異形體的方式有三種:(1)組成分子的原子數目不同,如氧氣O、臭氧O;(2)晶體裡原子的排列方式不同,如金剛石、石墨;(3)晶體裡分子的排列方式不同,如菱形硫、單斜硫。 以第一種方式結合的同素異形體,由於分子中原子的數目不同,這種同素異形體的轉變中一定存在著化學鍵偽破裂和生成。如臭氧轉變成氧氣:臭氧中的兩個 鍵,一個 鍵破裂,生成氧氣中的一個 鍵,兩個 鍵。因此這種同素異形體的轉變一定是化學變化。
對以第二種方式結合的同素異形體,由於晶體裡原子的排列方式不同,這種同素異形體的轉變中也一定存在著化學鍵的破裂和生成。如石墨轉變成金剛石。石墨晶體中六個碳原子分別以三個共價鍵圍成的正六角形平面網狀的片層結構,轉變成金剛石晶體中正四面體型的空間網狀結構,其中碳原子間的化學鍵發生了破裂和生成。故這種同素異形體的轉變也一定是化學變化。
對以第三種方式結合的同素異形體,由於只是晶體裡分子的排列方式不同,而分子的組成和結構仍未變化,因而這種同素異形體的轉變中不存在化學鍵的破裂和生成。如菱形硫在95.5℃時不經熔化可直接變成單斜硫。菱形硫和單斜硫的分子組成都是S,它們的結構都是由八個硫原子靠共價單鍵圍成的八元環。所以這種同素異形體的轉變應屬於物理變化。
 白磷、紅磷轉變示意圖
白磷、紅磷轉變示意圖綜上所述同素異形體的轉變可以是物理變化,也可以是化學變化。但是同 素異形體的轉變往往是很複雜的。如白磷在260℃於密閉容器中首先變成磷蒸氣,然後磷蒸氣冷卻再變成紅磷。前半過程,磷變成磷蒸氣應是物理變化,後半過程,磷蒸氣變成紅磷,是四個P原子組成的四面體型的白磷撕裂開一個P一P鍵,然後許多個成對的等邊三角形連線起來形成長鏈狀的紅磷分子。白磷轉變成紅磷的結構示意如右圖所示。
由此可見,這後半過程中有化學鍵的破裂和生成,應屬於化學變化。同素異形體的轉變是物理變化,還是化學變化要視具體情況從它們的組成和結構上分析,看有無化學鍵的破裂和生成。 如第一、第二種方式結合的同素異形體,如果沒有化學鍵的破裂和生成則也應屬物理變化。
硫的同素異形體形成原理初探
硫是一種重要的非金屬元素。它有多種同素異形體:有斜方硫、單斜硫和彈性硫。這些同素異形現象主要是由單質硫的分子S具有環狀結構,在不同溫度下加熱時發生了質的變化,引起了硫內部結構的變遷而引發起來的。
硫的結構
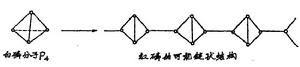
環八硫的性質是非常異常的,環狀硫在熔融的時候都有較大的變化。而硫的流動性是受外界溫度的影 響而產生分子結構變化的。在通常情況下,單斜硫和斜方硫都是由S分子所組成。在分子中,每個硫原子都以兩個共價鍵分別跟相鄰的另外兩個硫原子相結合形成曲折的八員環。由於環的變形性較大,所以S首先生成一種黃色透明、易流動的液體。高於160℃時,S的環開始破裂轉為開鏈,鏈與鏈之間可以互相連線而發生聚合作用形成很長的硫鏈,因而粘度漸增,顏色變深。在200℃時粘度達到最高點,進一步加熱時長鏈又開始斷裂,長鏈大分予斷裂為短鏈分子,粘度又重新降低,直至達到硫沸點,硫又成為一種較易流動紅褐色的液體。當加熱到沸騰硫變為硫燕氣時,根據蒸氣密度可知,硫的蒸氣中含有S、S6、S4、S等分子存在。約1000℃時,蒸氣的密度相當於S2分子,到1500℃時,S2分子開始分解為單原子S。
 同素異形變化
同素異形變化上述平衡隨著溫度的升高而向正反應方向移動。彈性硫的形成是由於S環的斷裂轉為開鏈,鏈與鏈之間能互相結合成為長鏈。由於S-S鍵能夠旋轉,硫鏈可皺曲,在外力作用下,硫鏈能伸長,放鬆拉力,彎皺的鏈縮回原狀。因此這種硫顯豐富的彈性。
硫的相圖
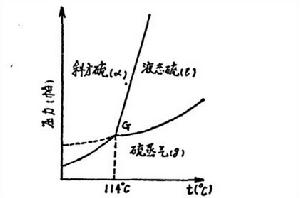 圖1 硫的相圖
圖1 硫的相圖硫隨著溫度的升高,分子結構發生變體,可存在著四 種相:單斜硫、斜方硫、液態硫和硫蒸氣。由於單組分體系中最多只能三相共存,因而在硫的相圖中有可能一共存在著四個三相點。 相圖(1)是斜方硫 ,液態硫與硫蒸氣三相間相互成平衡的情況。如果把斜方硫迅速加熱或者將液態硫迅速冷卻便可能出現圖(1)中所示的斜方硫與液態硫間的平衡狀態。但如果斜方硫緩慢加熱或者液態硫緩慢冷卻,便得不到斜方硫或液態硫與單斜硫之間的二相平衡。