概述
反應過電壓是指能量在轉化過程中會不可避免地發生一些不可逆損失,該電壓損失的作用是在化學反應中驅使電子到達或者離開電極。在反應中除去導線,電解質溶液的電壓損耗,還存在著與電極反應有關的附加電壓,這部分電壓,稱之為過電壓。由此看來,實際分解電壓應等於理論分解電壓、歐姆電壓降和過電壓之和 。
性能分析
1905年,Tafel報導了在各種各樣的電化學反應中電極表面的過電壓的相似模式。該模式揭示了電極表面的過電壓與電流的近似對數比例關係:
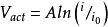 反應過電壓
反應過電壓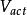 反應過電壓
反應過電壓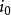 反應過電壓
反應過電壓式中: 為反應過電壓;i為電流;A為比例常數; 為交換電流密度,即電壓剛好離開零點時的電流密度。燃料電池內部的化學反應是可逆反應:
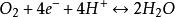 反應過電壓
反應過電壓當電流密度為零時,並不是燃料電池內沒有發生反應,而是正、逆反應趨於平衡,此時的電流密度就稱為交換電流密度。交換電流密度高,說明在燃料電池電極上發生的反應劇烈,反應過電壓小。研究發現,活化主要發生在陰極側,陽極產生的電壓很小 。
計算模型
反應過電壓在陰極和陽極的電極上都有發生。陰極發生的是氧氣的還原反應,即氧氣與從陽極傳遞過來的氫離子反應生成水,而陽極的反應速度控制步驟是氫氣的吸附過程。總的反應過電壓就等於陰極和陽極的活化之和 。
電池的活化就表示成了電池的溫度、電流和物質濃度的函式。各個ξi的值可以根據測量的PEMFC曲線,通過擬合程式得到。由於物質濃度不是PEMFC主要的操作參數,所以,可將它們進一步表示成溫度和壓力的函式:
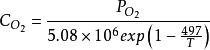 反應過電壓
反應過電壓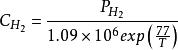 反應過電壓
反應過電壓
