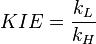一級同位素效應
當一個反應進行時, 在速度決定步驟中發生反應物分子的同位素化學鍵的形成或斷裂反應,將顯現出一級同位素效應( Primary Isotope Effect)。一級同位素效應的機理現已很清楚 ,即由於同位素質量不同, 反應物的零點能不同, 從而導致各自的反應速率不同 。用數學式表示為:
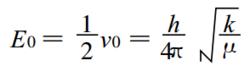 02
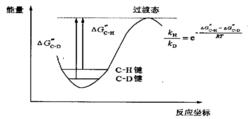
02其中 k 是與溫度有關的常數 , μ是折合質量。對於氫的同位素來說, 由於 D 的折合質量大約是 H 的 2 倍 ,所以 D 的零點能比 H 小 ,這種關係可用簡單的能級圖如下:
 03
03根據紅外光譜, 比較明顯的 C —H 的伸縮振動頻率在 2900 ~ 3100cm-1之間 , 由於 D 比較重,特徵的伸縮振動頻率在 2050 ~ 2200cm-1之間[ 2] 。可以預計 ,在發生反應時, C —H 鍵比 C —D 鍵活潑,通過計算可知 C —H 鍵的零點振動能比 C —D 鍵要高大約 5kJ/mol( E0( C —H)=17 .4kJ/mol , E0( C —D) =12 . 5kJ/mol),這意味著 C —D 鍵比 C —H 鍵斷裂困難。對在過渡態中涉及C —H( D) 斷裂或者伸展彎曲的反應 ,動力學同位素效應的大小直接反映鍵的斷裂或者伸展彎曲程度。通常當 kH/ kD 在 2 ~ 7 範圍內時,才認為該反應是一級同位素效應控制的反應。
二級同位素效應
在有些被觀察到的同位素效應中, 被取代的氫原子和反應沒有直接的關係 ,同位素參與的化學鍵不發生斷裂, 但可能減弱或者重新雜化 ,並且在反應中是速度決定步驟 ,這樣的效應叫二級同位素效應( Secondary Isotope Effect)。這類效應比一級同位素效應小 ,通常 kH/ kD 在 0 . 7~ 1 . 5 範圍[ 5] 。當 1 <kH/ k D <1 . 5 時, 稱為常規二級同位素效應( Normal Secondary IE) , 通常當同位素 原子 所連的 C 原 子由 sp3 雜 化變 為 sp2 雜化 時是常 規二 級同 位素效 應; 當0 . 7 <kH/ k D <1時, 稱為逆反二級同位素效應( Inverse Secondary IE), 通常當同位素原子所連的C 原子由 sp2 雜化變成 sp3 雜化時是逆反二級同位素效應。
α二級同位素效應
當同位素原子和涉及鍵斷裂的原子連線在同一個原子上時 ,稱這種效應為 α二級同位素效應( αSecondary IE)。產生 α二級同位素效應的主要原因是當同位素取代後 ,面外彎曲振動在過渡態和基態所受的影響不同[ 8] ( 由於 C —H 比 C —D 長 ,C —H 鍵彎曲狀態的自由度比 C —D 鍵大),而引起反應速率的變化。利用 α二級同位素效應可以區別 SN1 和 SN2 反應 。SN1 反應的氘同位素效應( kH/ kD =1 . 08 ~ 1 . 25) 比 SN2 大。其數值的大小與被取代的基團 、溶劑和可能形成的離子對的性質有關。下圖為 SN1 反應的示意圖 。
從上圖中很容易看出,離去基團的離開使得反應中心 C 周圍的空間由緊密變疏鬆。一般的規律是 ,由於 C —H 鍵比 C —D 鍵長 ,連線 H 原子的 C 比連線 D 原子的 C 更容易完成由 sp3 雜化到 sp2 雜化的轉變。
β 二級同位素效應
β 二級同位素效應( β Secondary IE) 指同位素原子連線在反應中心的 β 位原子上時對反應產生的同位素效應。 β 二級同位素效應的數值也比較小, 一般在 1 . 0 ~ 2 . 3 之間, 而且只有很少數超過 1 . 5 的。過去對 β 二級同位素效應的原因有過很多爭論, 隨著過渡態理論的發展, 人們更多地用到超共軛效應去解釋 β 二級同位素效應 。支持超共軛作用解釋 β 二級同位素效應的實驗事實是: ①當 D 變成離去基時( 這時過渡態呈現明顯的碳正離子特徵) , 同位素效應最大 。 ②二級同位素效應可以通過不飽和體系轉移( 見圖 3),由於 C —H 鍵能比 C —D 鍵能低,離去的難易程度不同 ,這是 β 二級同位素效應產生的機理。 ③只有當β —H( D) 能與 α —C 的 p 軌道發生重疊時, 才能觀察到 β 二級同位素效應 。例如PhCD2CH2Ots甲酸反應中 ,因為過渡態有鄰基( 苯基) 參與使 β —H( D) 的構象位置處於 α—C 的 p 軌道節面上,沒有超共軛作用 ,以致觀察不到同位素效應。
重原子同位素效應
以上介紹的大都是 H/D 的同位素效應 ,它們可以用體系的 kH 、kD 以及 kT 的比值來表示 。在實驗過程中 , 還用到其他重原子同位素效應( Heavy-atom Isotope Effect), 例如 C 、N 、O 、P 、Br等。這些元素的同位素效應涉及到的大都是一級同位素效應 , 但數值一般比較小 , 例如在25 ℃時,最大值的幾個元素的速率常數比值為: k12/ k13 =1 . 04 ; k12/ k 14 =1 . 07 ; k14/ k 15 =1 . 03 ;k 16/ k 18 =1 . 02 。這些比值雖小 , 精度卻很高, 可以用於反應機理研究, 但需要精密的儀器。