概念介紹
一種物質或幾種物質分散在另一種物質中所形成的系統稱為分散系。其中被分散的物質稱為分散質(分散相),分散質所處的介質稱為分散劑(或分散介質)。
按分散質粒子的大小,可將分散系分成三類:真溶液、膠體分散系和粗分散系。當分散質粒子的直徑小於1 nm(相當於分子或離子大小)時所形成的均勻的穩定體系稱為真溶液。
當分散質粒子的直徑大於100nm時所形成的分散係為粗分散系。粗分散係為多相不穩定體系。
分散質粒子大小介於1~100nm的分散係為膠體分散系。膠體分散系中的分散質粒子通常是眾多分子(或離子)的聚集體,為多相體系。
物質的分散程度影響著物質的某些物理化學性質,而物質的分散程度與物質的表面積大小有直接的關係。某一物質被分散得越細,分散程度越高,總表面積就越大,通常用比表面的大小表示物質的分散度。
比表面積a是單位質量的固體所擁有的表面積。
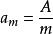 分散度
分散度式中,A-物質總表面積,m-物質總質量。
或是單位體積物體所擁有的表面積a
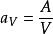 分散度
分散度式中,A-物質總表面積,V-物質總體積。
任何物質都具有表面,物質表面上的質點與內部質點受到的作用力不同。物質內部質點所受合力為0,而表面分子所受合力不為0,合力方向指向物質內部(下圖),因而表面的質點都有向內遷移,使表面積減小的趨勢。
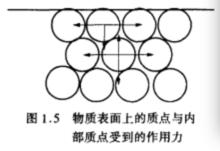 物質表面上的質點與內部質點受到的作用力
物質表面上的質點與內部質點受到的作用力如果把內部分子拉向表面,就必須吸收能量,克服指向物質內部的力。當這些內部分子轉移出來,形成新表面時,這部分能量就轉變成表面層分子的勢能,因而表面層分子此內部分子的能量高,高出部分的能量稱為表面能。顯然,物質分散程度越大,比表面越大,表面能就越高。液體和固體都有自動減小表面能的能力。通常以凝聚和吸附的途徑來降低物質的表面能。
影響
物質的分散度愈大,其表面積和比表面也愈大,相應的表面吉布斯自由能亦愈大。從熱力學觀點來看,這類高分散系統就愈不穩定。必然會引起系統的物理化學性質如蒸氣壓、沸點、熔點及其溶解度的變化,進而出現過冷、過熱、過飽和及化學活性改變等各種表面現象。
飽和蒸氣壓
液體蒸氣壓的大小決定於液體分子向空間逃逸的傾向,這種傾向不僅與液體的本性和溫度有關,而且還與液體的分散度(即曲率半徑)有關。若在一塊平板玻璃上放置一些大小不等的水滴,然後罩上玻璃罩,放置一段時間後,可以發現小水滴愈來愈小直至消失,而大水滴逐漸變大,這個現象說明半徑小的小水滴的蒸氣壓比半徑大的大水滴的蒸氣壓大。液體飽和蒸氣壓與曲率半徑之間的定量關係可以用熱力學方法導出:
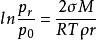 分散度
分散度式中,p-半徑為r微小液滴的飽和蒸氣壓;
p-平面液體的飽和蒸氣壓;
M-液體摩爾質量;
ρ-液體密度;
σ-純液體表面張力。
上式稱為Kelvin方程,它表明液滴半徑愈小,與之呈平衡的蒸氣壓愈大。
對於凸液面(如液滴),r>0,上式右邊為正,則ln(p/p)>0,則p>p,即P>p;
而對於凹液面(如液體中的小氣泡),r<0,則ln(p/p)<0,則p<p,即P<p;
對於平面液體,r=∞,ln(p/p)=0,所以p=p,即P=p。
綜上所述,可以得到:在一定溫度下,對同一種液體有P>p>p,可知有凸面液體的蒸氣壓恆大於平面液體的蒸氣壓,且液滴愈小其蒸氣壓越大。
溶解度影響
分散度對溶解度的影響可以用與微小液滴蒸氣壓與曲率半徑之間的Kelvin方程類似的公式表示為:
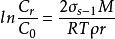 分散度
分散度式中C和C分別是微小晶體與普通晶體的溶解度,σ表示晶體與溶液之間的界面張力,M為晶體物質的摩爾質量,ρ為晶體物質的密度,r為微小晶粒的半徑。由上式可知,微小晶體的溶解度大於普通晶體的溶解度,而且晶粒的半徑愈小其溶解度也愈大。
新相生成
1.過飽和蒸氣(Supersaturated Steam)
按照相平衡條件,將溫度降低到露點以下,應當凝結而未凝結為液體的蒸氣,稱為過飽和蒸氣。例如在0℃附近,水蒸氣有時要達到5倍於平衡蒸氣壓的過飽和度,才開始自動凝結。其他如甲醇、乙醇及乙酸乙酯的蒸氣也有類似情況。
過飽和蒸氣之所以能夠存在,是因為蒸氣冷凝成液滴,從原有氣相要產生一個新相-小液滴。根據Kelvin方程,新產生的小液滴的蒸氣壓大於平面液體的蒸氣壓,因此開始時的過飽和度尚未達到微小液滴的飽和狀態,新相生成困難。而當蒸氣中有灰塵存在或有其他固體粒子作為凝結中心時,可以大大降低其過飽和程度,使液滴核心易於生成及長大,人工降雨就是基於這個道理。
2.過熱液體(Superheated Liguid)
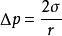 分散度
分散度過熱液體是加熱到沸點以上應當沸騰但仍不沸騰的液體。產生過熱液體的原因是液體在沸騰時,不僅在液體表面層產生汽化,並且在液體內部要自動地生成極微小的氣泡(新相)。此時液面是凹面,其蒸氣壓小於正常蒸氣壓,同時,形成小氣泡時,還要克服很大的附加壓力 。因此,要使液體中沸騰產生新相小氣泡,就必須充分加熱升溫而產生過熱現象。燒開水時,氣泡常常從壺底和壺壁冒出,這是因為壺底和壺壁上附著一些空氣泡,可以作為液體蒸發的中心而促使液體沸騰。在實驗室中為了防止液體過熱引起暴沸現象,常在加熱液體中預先加入一些素燒瓷片、泡沸石或是一端封口的毛細管,這些物質多孔表面中的氣泡存在可作為新相種子使過熱程度降低。
3.過冷液體(Supercooled Liquid)
按相平衡條件,將溫度降低到正常凝固點以下,應當凝固而未凝固的液體,稱為過冷液體。如純淨的水,有時可冷卻到-40℃,仍呈液態而不結冰。通常把正常凝固點瓦與過冷液體的溫度之差稱為過冷度。即:過冷度=T-T。
產生過冷現象的主要原因是因為微小晶體的飽和蒸氣壓遠大於普通晶體的飽和蒸氣壓,如下圖所示。
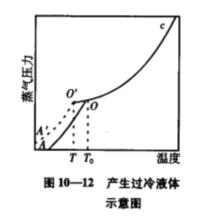 產生過冷液體示意圖
產生過冷液體示意圖4.過飽和溶液(Super-saturated Solution)
按照相平衡條件,溶液的濃度大於一定溫度下物質的飽和濃度尚未析出晶體的溶液,稱為過飽和溶液。過飽和溶液的形成是由於微小晶體的溶解度大於普通晶體的溶解度。由於溶液最初析出的晶體粒子都很小,它的溶解度大於普通晶體,來不及長大又溶解了。因此要使微小晶體的新相產生並繼續長大,溶液必須有足夠的過飽和度。
在生產工藝的結晶操作中,若溶液的過飽和程度太大,將會生成很細小的晶粒,不利於過濾和洗滌,從而影響產品的質量。通常採用向結晶器中投入小晶體作為新相種子的方法,防止溶液的過飽和程度過高,以期獲得較大顆粒的晶體。
5.新相生成與介安狀態
上述產生的過飽和蒸氣、過熱液體、過冷液體和過飽和溶液等現象,其共同點是在系統中產生新相較為困難。從熱力學的觀點看,這是由於最初生成的新相顆粒極其微小,比表面很大,相應的表面吉布斯自由能也很高,使系統處於不穩定狀態。雖然實際上它能較長時間存在,但系統並不是處於真正的平衡狀態。
通常把這種熱力學不穩定而又能長時間存在的狀態稱為亞穩狀態或介安狀態。亞穩狀態之所以能維持相當長時間,與新相種子難以形成有一定聯繫。
亞穩狀態在日常生活和生產過程中具有重要意義。根據具體情況有時需要保持,有時需要消除這種狀態。例如金屬的淬火,就是將金屬製品從高溫下取出,放入水、油或其他介質中迅速冷卻,以保持其在高溫時的某些結構及特殊性能。而與淬火相反的退火過程,則是消除金屬過飽和狀態的一種手段,使金屬重新結晶消除介安狀態而形成穩定組織。例如將白口鐵中以亞穩狀態存在的FeC(硬而脆)退火後緩慢冷卻,則滲碳體FeC分解為鐵和石墨。白口鐵高溫退火後得到可鍛鑄鐵,改善了產品的機械性能。
影響
分散度的大小不僅影響物質的物理性質,也對物質的化學活性產生顯著的影響。煤塊很難點燃,但煤粉燃燒卻很容易,甚至引起爆炸。而分散為極細粉末的鐵、鎳、鈷、錳具有很強的化學活性,以致在空氣中會發生自燃現象。
在高度分散體系中,表面效應不能忽視。整個系統吉布斯自由能變化包括體相部分(為考慮表面特性)和表面效應所多出來的那部分吉布斯自由能變兩部分之和,即:
dG=dG+dG
因此,一般而言,反應物的分散度增高,則其化學活性增大,有利於正反應的進行。反之,產物分散度增大則不利於正反應而有利於逆反應的進行。
