概念和來源
二倍體細胞(diploid cell)
含有兩個染色體組的細胞,通常以2n表示體細胞的染色體數目,用n表示性細胞的染色體數目。
概念
 二倍體細胞
二倍體細胞來源
二倍體細胞株來源於正常人胎兒組織,主要用於培養病毒製備疫苗等。
 二倍體細胞
二倍體細胞細胞株的要求
 二倍體細胞
二倍體細胞細胞株的要求
用於疫苗生產的人二倍體細胞株(以下簡稱細胞株)須按下列規定進行全面檢定。新建立細胞株,應按《新生物製品審批辦法》進行審批。
具備的資料
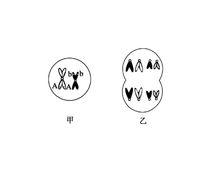 二倍體細胞
二倍體細胞1.1 建立細胞株所用的胎兒的胎齡和性別,中止妊娠原因。
1.2 建立細胞株所用胎兒的父、母年齡、職業及健康狀況,胎兒父、母系三代應無明顯遺傳缺陷和腫瘤疾病歷史。在取胎兒組織時,應作出詳細調查,報衛生部審批前,應進行一次重複調查。
1.3 原始組織種類,原代培養的數量與生長狀況。
1.4 細胞培養史和生長特徵,細胞壽命、世代數。
1.5 細胞生長液的成分。
細胞株的檢定
 二倍體細胞
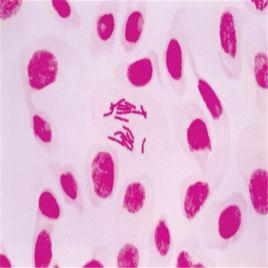
二倍體細胞2.1 染色體的鑑定和製片
細胞原系建株過程,每8~12世代*應作一次染色體檢查,一株細胞整個生命期內連續培養過程中,至少應有4~5次染色體檢查結果。
每次染色體檢查,應從同一世代不同細胞培養瓶中取細胞混合再培養,製備染色體標本片。染色體標本應長期保存(直至褪色不能用為止),以備複查。
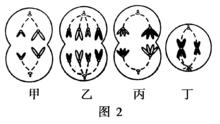 二倍體細胞
二倍體細胞每次染色體檢查,至少應隨機取1000個分裂中期細胞,進行染色體數目、形態和結構檢查,並作出有助於複查的記錄,其中至少選擇50個分裂中期細胞進行顯微照相,作出核型分析。並應粗數500個分裂中期細胞,檢查多倍體的發生率。
可以G分帶或Q分帶技術檢查50箇中期細胞染色體帶型,套用照相圖片作出帶型分析。以顯帶技術檢出的核型異常(假二倍體、倒位、易位等)發生率套用比現用上限更寬的基本數據進行評價,合格上限尚未定出。
2.2 外源因子檢查
細胞株不應有細菌、黴菌、支原體和病毒等污染。每8~12世代細胞培養物,應進行下列檢查。
2.2.1 細菌、黴菌、支原體檢查
按《生物製品無菌試驗規程》進行。
 病毒檢查
病毒檢查2.2.2 病毒檢查
2.2.2.1 細胞直接觀察及紅細胞吸附試驗
取混合瓶細胞樣品,接種小瓶或小管,長成單層後更換維持液,觀察2周,鏡檢細胞,應保持正常形態特徵。培養7天,用0.2%~0.5%雞和豚鼠混合紅細胞懸液進行紅細胞吸附試驗,先置於4~8℃,後置於20~25℃,各30分鐘,兩次觀察結果均應為陰性。
2.2.2.2 細胞培養檢查
細胞培養的上清液混合樣品,至少接種4種細胞(原代人腎或猴腎細胞、原代兔腎細胞、人源傳代細胞和另一批人二倍體細胞)。接種的樣品量應占維持液的20%以上,於培養5~7天和14天時,進行紅細胞吸附試驗(見2.2.2.1項)。培養7天的上清液在同種細胞培養上盲傳一代,觀察14天,應無細胞病變,紅細胞吸附試驗應為陰性(在該試驗的細胞維持液中,允許加入少量該細胞培養用的牛血清,以利細胞維持和觀察)。
2.2.2.3 動物試驗檢查
用乳鼠、成鼠、家兔、豚鼠和雞胚各一組。每組動物或雞胚接種受檢細胞不應少於107。按表2所列要求進行試驗和觀察。如80%以上動物和雞胚健存,此試驗為通過。
2.2.2.4 其他檢查
細胞株傳代過程中,至少於2個不同世代水平進行包涵體、B型肝炎表面抗原及電鏡檢查,結果均應為陰性。