藥品信息
基本信息
【通用名稱】醋酸加尼瑞克注射液
【商品名稱】ORGALUTRAN
【漢語拼音】CusuanJia’niruikeZhusheye
【英文名稱】GanirelixInjection
【規格】0.5ml:0.25mg(以加尼瑞克計)
【包裝】一次性預填充注射器(I型矽化玻璃),含0.5ml無菌,可供使用的水溶液,用橡膠塞(不含乳膠)封閉。每個預填充注射器附帶一個針頭,針頭用天然橡膠製成的針頭護帽封閉(見【注意事項】)。
每盒裝有1支或5支注射器。
【貯藏】2-30°C貯藏,不得冷凍。
貯藏在原包裝內,以避光保存。
【有效期】24個月
【執行標準】進口藥品註冊標準JX20050220
【批准文號】H20130386
【生產企業】
公司名稱:N.V.Organon
地址:Kloosterstraat6,5349ABOss,TheNetherlands
生產廠名稱:VetterPharma-FertigungGmbH&Co.KG
地址:Schutzenstrasse87and99/101,D-88212Ravensburg,Germany
包裝廠名稱:Organon(Ireland)Ltd.
地址:DrynamRoad,Swords,Co.Dublin,Ireland
【成份】本品活性成份為:醋酸加尼瑞克
活性成份加尼瑞克(INN)是一種合成十肽,對天然生成的促性腺激素釋放激素(GnRH)具有高的拮抗活性。通過替代天然GnRH的第l、2、3、6、8、10位點上的胺基酸而形成以下肽分子式。
本品其他組份為:冰醋酸,甘露醇,注射用水,用氫氧化鈉和醋酸調節pH值。
化學名稱:N-乙醯-3-(2-萘)-D-丙氨醯-4-氯-D-苯丙氨醯-3-(3-吡啶)-D-丙氨醯-L-絲氨醯-L-酪氨醯-N6-[雙(乙氨)亞甲基]-D-賴氨醯-L-亮氨醯-N6-[雙(乙氨)亞甲基]-L-賴氨醯-L-脯氨醯-D-丙氨醯胺醋酸鹽
化學結構式:
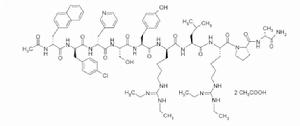 ORGALUTRAN
ORGALUTRAN分子式:CHNOCl.CHCOOH
分子量:1690.42
本品其他組份為:冰醋酸,甘露醇,注射用水,用氫氧化鈉和醋酸調節pH值。
【性狀】本品為無色的澄明溶液。
適應症
本品在接受輔助生殖技術(ART)控制性卵巢刺激(COS)方案的婦女中使用,用於預防過早出現促黃體激素(LH)峰。
用法用量
本品應由對治療不孕症有豐富經驗的專業醫師開立處方。
劑量
本品用於預防接受COS治療過程中提早發生的LH峰。接受COS治療的患者一般在月經周期第2或第3天開始使用卵泡刺激素(FSH),依據卵巢反應(例如生長發育的卵泡數量和大小以及/或外周血循環中的雌二醇水平),及時給予本品(0.25mg),每天一次,可有效預防早發LH峰的出現。根據臨床套用經驗,一般在FSH用藥後第5天或第6天開始使用本品,但開始給藥的時間應根據患者的個體化卵巢反應而決定。
本品和FSH應大約同時給藥,但這兩種藥物不得混合,而且要在不同部位注射。
FSH劑量調整應基於生長發育的卵泡數量和大小進行,而不是循環中的雌二醇水平(見【藥理毒理】)。為預防多卵泡發育導致的早發LH峰,本品應連續每日治療,直至出現大小足夠且數量充足的卵泡後給予人絨毛膜促性腺激素(hCG)誘導卵母細胞最後的成熟。
由於加尼瑞克的半衰期原因,本品兩次注射的時間間隔以及本品最後一次注射和hCG注射的時間間隔不應超過30個小時,否則會出現早發的LH峰。因此,本品早晨用藥時,自進行FSH卵巢刺激的第5或第6天開始給予本品,持續整個FSH治療過程至誘發排卵的當日(包括誘發排卵當日);本品晚間用藥時,自進行卵巢刺激的第5天開始給予本品,持續整個FSH治療過程至誘發排卵的前一夜。
本品對黃體期支持的需要還未進行研究。在臨床試驗中,根據生殖醫學中心的經驗給予黃體期支持。
肝臟或腎臟損害受試者:本品沒有肝臟或腎臟損害受試者的使用經驗,因此,不能給出特定的推薦劑量(見【禁忌】)。
給藥方法
本品應皮下注射,最好是在大腿部。為防止皮下脂肪萎縮,應循環更換注射部位。如果能對患者或其伴侶給予充分指導,並可獲得專家建議,可以自行注射本品。
不良反應
在包括1589名接受本品治療的患者的臨床試驗中,下列不良反應及其發生率較為明顯:
全身和給藥部位反應
本品可能導致注射部位局部皮膚反應(主要表現為皮膚發紅,伴或不伴腫脹)。在臨床研究的每個治療周期中,根據患者報告,注射後一小時,至少出現一次中度或嚴重的局部皮膚反應的發生率在接受本品治療的患者中為12%,而在接受促性腺激素釋放激素(GnRH)激動劑治療的患者中為25%。局部反應通常在給藥後4小時內消失。0.3%的患者報告有不適感。
免疫系統紊亂
上市後監測顯示,在給予本品的患者中,有極少病例報告在給予初次劑量時即發生超敏反應(包括各種症狀,如皮疹,面部腫脹,呼吸困難)。
神經系統紊亂
頭痛(0.4%)。
胃腸紊亂
噁心(0.5%)。
報告的其他與輔助生殖技術控制性卵巢刺激治療相關的不良反應有明顯的盆腔疼痛,腹脹,卵巢過度刺激綜合徵(OHSS),異位妊娠及自然流產(見【注意事項】)。
禁忌
•對本品活性成份或其中任何輔料過敏者禁用。
•對GnRH或任何其他 GnRH類似物過敏者禁用。
•中度或重度腎臟或肝臟功能損害者禁用。
•懷孕或哺乳期者禁用。
注意事項
對有過敏體徵或症狀的婦女應特別注意觀察。在上市後不良反應監測中,有在使用初次劑量時即出現超敏反應案例的報導(見【不良反應】)。在缺少臨床經驗的情況下,不建議對有嚴重過敏情況的婦女給予本品治療。
本品的包裝材料含天然乳膠,可能導致過敏反應(見【包裝】)。
在卵巢刺激期間或之後可能會發生OHSS。必須考慮OHSS是促性腺激素刺激的內在風險。OHSS應對症治療,例如休息,靜脈滴注電解質溶液或膠體和肝素。
由於接受輔助生殖,尤其是體外受精(IVF)的不孕婦女,經常有輸卵管異常的情況,異位妊娠的發生率可能增加。因此早期超聲證實宮內孕是很重要的。
採用ART的先天性畸形發生率可能略高於自然懷孕,這被認為與父母的生物學特徵(例如,產婦的年齡,精子特徵)以及多胞胎的高發生率相關。1000多個新生兒的臨床試驗證明,採用本品進行COS治療後出生的嬰兒的先天性畸形發生率與使用GnRH激動劑進行COS治療所報告的發生率相似。
本品在體重超過90公斤的婦女中的安全性和有效性還沒有確立。
尚未對本品進行駕駛和機器操作能力影響的研究。
本品沒有進行藥物相容性研究。本品一定不能與其他藥物混合使用。
使用前請檢查注射器。僅在注射器包裝完好,且在溶液清澈,無微粒的情況下使用。
任何未使用的藥物或者廢棄的材料應該按照當地的要求處置。
【孕婦及哺乳期婦女用藥】
尚無孕婦使用加尼瑞克的臨床數據。
動物實驗中,在胚胎植入時暴露於加尼瑞克會導致胚胎再吸收(見【藥理毒理】)。這些數據與人的相關性還未知。
尚不清楚加尼瑞克是否通過母乳分泌。
懷孕和哺乳期間禁止使用本品(見【禁忌】)。
【兒童用藥】不適用。
【老年用藥】不適用。
藥物相互作用
尚未進行本品與其他藥物相互作用的研究。
不能排除本品與常規藥物,包括組胺釋放藥物相互作用的可能性。
【藥物過量】
在人體中藥物過量可能導致藥物作用時間的延長。當藥物過量時,應暫時停止本品的治療。
尚無本品對於人體的急性毒性數據。本品單劑量最高達12mg的皮下給藥臨床研究未顯示有全身不良反應。在對大鼠和猴子的急性毒性研究中,只有靜脈注射加尼瑞克超過1mg/kg和3mg/kg後觀察到非特異性毒性症狀,如血壓過低和心動過緩。
藥理毒理
藥理作用
促性腺激素釋放激素(GnRH)的脈衝式釋放能夠刺激LH和FSH的合成和分泌。卵泡期中期和後期的LH脈衝頻率大約是每小時1次。這些脈衝體現在血清LH的瞬時上升。在月經中期,GnRH的大量釋放造成LH激增。月經中期的LH激增能引起數個生理反應,包括:排卵、卵母細胞減數分裂恢復和黃體形成。黃體形成造成血清黃體酮水平上升,同時雌二醇水平下降。
醋酸加尼瑞克是GnRH拮抗劑,可競爭性阻斷垂體促性腺細胞上的GnRH受體,以及其後的轉導通路。它產生一種快速、可逆的促性腺激素分泌抑制作用。醋酸加尼瑞克對腦垂體LH分泌的抑制作用強於對FSH的抑制作用。醋酸加尼瑞克不能引起內源性促性腺激素的首次釋放,這與拮抗作用一致。醋酸加尼瑞克停藥後48小時內,垂體LH和FSH水平可完全恢復。
毒理研究
遺傳毒性:醋酸加尼瑞克Ames試驗、CHO細胞染色體畸變試驗結果均為陰性。
生殖毒性:妊娠大鼠和兔自第7天開始給予醋酸加尼瑞克,劑量為10、30ug/kg/天(按體表面積計算,約0.4-3.2倍於人體劑量),可見窩吸收發生率增加,未見胎仔異常。雌性大鼠妊娠和哺乳期間給予醋酸加尼瑞克,未見子代出現給藥相關的生育力、體格與行為變化。
醋酸加尼瑞克注射液的抗促性腺激素作用能夠引起激素水平變化導致胚胎吸收,並造成胎兒丟失。禁止妊娠婦女使用醋酸加尼瑞克注射液。
藥代動力學
國外數據
對國外女性志願者進行0.25mg加尼瑞克的單次皮下給藥後,血藥濃度在1-2小時(tmax)內達到峰濃度(Cmax),約為15ng/ml。消除半衰期(t½)約為13小時,清除率約為2.4l/h。經糞便(約75%)和尿液(約22%)排泄。本品皮下給藥後的生物利用度約為91%。
在國外女性志願者中,本品多次皮下給藥(每日一次注射)後的藥代動力學參數與單次皮下給藥後的藥代動力學參數相似。在多次進行0.25mg/日給藥後的2-3天內,血藥濃度達到穩態水平,約為0.6ng/ml。
國外試驗的藥代動力學分析顯示,體重和本品血藥濃度呈反比關係。
代謝模型
血漿中主要的循環組份是加尼瑞克。加尼瑞克也是尿液中發現的主要化合物,糞便中只含有代謝物。代謝物為加尼瑞克在其酶切限制位點被酶切水解形成的小肽片段。本品在人體與動物中的代謝模型相似。
中國人數據
對健康中國女性志願者進行0.25mg加尼瑞克的單次皮下給藥後約1小時,平均血藥濃度為7.88ng/mL。平均消除半衰期時間、體重標準化後的清除率和體重標準化後的分布體積估計分別為12.1小時、80mL/h/kg和1.4L/kg。
臨床數據研究
國外III期臨床試驗
研究38607是以布舍瑞林長方案為對照,評估本品在接受控制性卵巢刺激的歐洲婦女中的安全性和有效性研究。納入意向治療人群的受試者共701名(本品組463名,布舍瑞林組238名)。主要入選標準為,年齡18-39歲,體重指數在18-29kg/m2之間,月經周期在24至35天的正常範圍內。本品組於FSH治療第6天開始皮下注射本品(0.25mg/天),直至接受hCG之日(包括該日);布舍瑞林組於月經周期的第21-24天開始接受治療(0.6mg/天,經鼻給藥),14天后如達到降調節(E2≤50pg/mL)則開始接受FSH治療,直至接受hCG之日。主要療效指標為取卵當天獲得的卵母細胞數。以每啟動周期計算,本品組受試者獲得的卵母細胞平均數為8.7,布舍瑞林組為9.7,差異的97.5%置信區間下限為-1.8。
研究103001是以亮丙瑞林長方案為對照,評估本品在接受控制性卵巢刺激的北美婦女中的安全性和有效性研究。納入意向治療人群的受試者共297名(本品組198名,亮丙瑞林組99名)。主要入選標準與研究38607相同。本品組於FSH治療第6天開始皮下注射本品(0.25mg/天),直至接受hCG之日(包括該日);亮丙瑞林組於月經周期的第21-24天開始接受皮下注射(1.0mg/天),14天后如達到降調節(E2≤50pg/mL)則開始接受FSH治療,直至接受hCG之日。主要療效指標為取卵當天獲得的卵母細胞數。以每啟動周期計算,本品組受試者獲得的卵母細胞平均數為11.1,亮丙瑞林為13.5,差異的97.5%置信區間下限為-4.0。
研究38616是以曲普瑞林長方案為對照,評估本品在接受控制性卵巢刺激的歐洲和中東婦女中的安全性和有效性研究。納入意向治療組的受試者共337名(本品組226名,曲普瑞林組111名)。主要入選標準與研究38607相同。本品組於FSH治療第6天開始皮下注射本品(0.25mg/天),直至接受hCG之日(包括該日);曲普瑞林組於月經周期的第21-24天開始接受皮下注射(0.1mg/天),14天后如達到降調節(E2≤50pg/mL)則開始接受FSH治療,直至接受hCG之日。主要療效指標為取卵當天獲得的卵母細胞數。以每啟動周期計算,本品組受試者獲得卵母細胞平均數為7.9,曲普瑞林為9.6,差異的97.5%置信區間下限為-2.4。
中國臨床試驗
研究38651是以曲普瑞林長方案為對照,評估本品在接受控制性卵巢刺激的中國婦女中的安全性和有效性研究。納入意向治療人群的受試者共233名(本品組113名,曲普瑞林組120名)。主要入選標準為,年齡18-35歲,體重指數在18-29kg/m2之間,月經周期在24至35天的正常範圍內。本品組於FSH治療第6天開始皮下注射本品(0.25mg/天),直至接受hCG之日(包括該日);曲普瑞林組於月經周期的第21-24天開始接受皮下注射(0.05mg/天),14天后如達到降調節(E2≤50pg/mL)則開始接受FSH治療,直至接受hCG之日。主要療效指標為達到注射hCG標準的第一天為止,所用FSH的藥量。本品組的FSH平均需求量分別為1272.0IU,顯著低於曲普瑞林組的1415.6IU。估計治療差異為-145.0IU,95%置信區間為[-212.0;-77.9]。
