HWE反應
HWE反應,即 Horner–Wadsworth–Emmons反應( 霍納爾-沃茲沃思-埃蒙斯反應),常誤稱為Wittig-Horner反應( 維蒂希-霍納爾反應)、 Horner-Wittig反應,是一個製取烯烴的反應,是Wittig反應的改進。反套用穩定的膦酸酯碳負離子,代替磷葉立德,與醛、酮反應生成烯烴。產物主要為E-型烯烴。
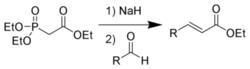 反應式
反應式1958年列奧波德·霍納爾(Leopold Horner)在研究其他有機磷化合物改進的Wittig反應時(主要是用氧化膦穩定的碳負離子),首先發表了用膦酸酯改進的Wittig反應。 而後威廉·沃茲沃思(William S. Wadsworth)與威廉·埃蒙斯(William D. Emmons)對反應作了進一步的研究。
一般參加反應的膦酸酯α-碳上需要連有吸電子基團(EWG),以使反應中的四元環中間體消除生成烯烴。反應的副產物O,O-二烷基磷酸鹽可溶於水,很容易通過水溶液萃取而與生成的不飽和酸酯分離。
反應機理
首先是膦酸酯α-碳的去質子化,生成碳負離子1。1與醛、酮2發生親核加成,由於立體取向不同,可以生成兩種產物3a及3b。這一步是決速步驟。3a和3b中的氧負離子進攻磷原子,生成一個氧雜的四元環中間體(oxaphosphetane),即4a和4b。若取代基R2為氫,則中間體3a、4a與3b、4b形成平衡,可以互相轉化(見假旋轉)。最後4a與4b發生逆[2+2]環加成反應,消除生成E型烯烴5和Z型烯烴6。
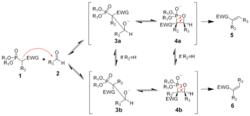 Horner–Wadsworth–Emmons反應
Horner–Wadsworth–Emmons反應反應生成的是烯烴的哪一個異構體(5與6),與碳負離子和醛酮加成時的方向有關,但也依靠反應的可逆性與兩個中間體之間的相互轉化。加成一步時,採取反疊構象,醛的氫原子儘量與較大的基團(如膦酸酯基)重疊,從而確保了下一步生成EWG與R3處於syn型的3a,消除得到E型烯烴。另一方面,也可以認為生成3a與3b的反應是可逆的,由於3b中兩個較大的基團(R3與EWG)處於同側,因此與3a相比較不易環化為四元環,會逐漸轉化為較穩定的3a。最後一步消除是不可逆的,從而3a一旦生成,就會很快生成4a,並消除為E型的烯烴;3b則會重新轉化為膦酸酯、3a,或直接轉化為3a,並很快生成4a、5。中間體之間的平衡越充分,產物中E型烯烴的比例就越高。與Wittig反應中的磷葉立德相比,膦酸酯形成的碳負離子的鹼性和親核性都更強。
原料膦酸酯可以很容易由亞磷酸酯與鹵代烴發生Michaelis-Arbuzov反應得到。若鹵代烴為溴代乙酸酯,則生成的膦酸酯在α-碳連有吸電子基(如酯基),可以很順利地發生消除生成烯。如果膦酸酯不含吸電子基團,反應的產物是α-羥基膦酸酯(3a、3b), 用二異丙基碳二亞胺處理脫水也能轉化為烯烴。
用酮反應時反應的立體選擇性一般不佳。
立體選擇性
二取代烯烴
Thompson和Heathcock在研究了(甲氧基羰基甲基)膦酸二甲酯與醛生成二取代烯烴的反應後,總結出以下使產物中E型烯烴比例增大的因素:
使用有位阻的醛;
高反應溫度(23°C > -78°C);
反套用鹼:Li > Na > K;
溶劑:DME > THF。
三取代烯烴
用α-雙取代的膦酸酯與脂肪醛發生HWE反應時,三取代烯烴的構型與膦酸酯所含基團的體積大小和吸電子基團的性質有很大關係。
改進
鹼
很多官能團對反應中強鹼性環境(如氫化鈉)的耐受性不好。對此有很多改進方法,比如Masamune和Roush的方法是用較為溫和的氯化鋰與DBU;Rathke的方法是用鋰或鎂的鹵化物與三乙胺的混合物,等等。
Still改進
以四氫呋喃作溶劑,用強吸電子基(三氟乙基)取代的膦酸酯在強解離環境下(KHMDS與18-冠-6)反應,HWE反應的立體化學特徵逆轉,生成以Z型烯烴為主的產物。這個方法稱為Still改進。
Wittig-Horner反應
Wittig-Horner反應 是用氧化膦穩定的碳負離子與醛加成,生成β-羥基氧化膦,而後與鹼作用,消除生成烯烴的反應。一般生成的β-羥基氧化膦都為非對映異構體的混合物。如果可以將中間產物羥基氧化膦分離,拆分為兩個非對映異構體,並分別與鹼在高溫下消除,則可以立體專一地生成烯烴的兩個異構體。erythro生成Z型烯烴,threo生成E型烯烴。或者也可先醯基化,再用硼氫化鈉和三氯化鈰還原。

