產品簡介
AMPK(Adenosine 5‘-monophosphate (AMP)-activated protein kinase) 即AMP依賴的蛋白激酶,是生物能量代謝調節的關鍵分子,是研究糖尿病及其他代謝相關疾病的核心。它表達於各種代謝相關的器官中,能被機體各種刺激激活,包括細胞壓力、運動和很多激素及能影響細胞代謝的物質。遺傳學和藥理學研究表明,AMPK是機體保持葡萄糖平衡所必需的。由於分子機制十分複雜,藥物分子激活AMP是一個巨大的挑戰,但其激活能改善由II型糖尿病引起的代謝失衡。
結構
 結構
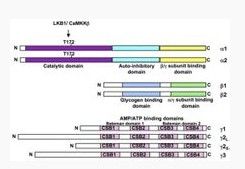
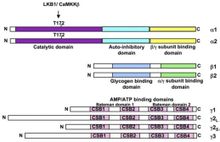
結構不同物種的AMPK蛋白均以一種異源三聚體複合物的形式存在,包括一個α-催化亞基、一個β-調節亞基和一個
γ-調節亞基組成。人類和齧齒動物分別由不同的基因表達兩種亞型的α-亞基和β-亞基(α1、α2;β1、β2),三種亞型的γ-亞基(γ1、γ2、γ3)。
α-亞基N-末端包含一個保守的Ser/Thr激酶區,包含一個保守的蘇氨酸(Thr-172)位點,該位點的磷酸化是其激酶活性所必需的。主要的上游磷酸化酶有AMP依賴的LKB1及Ca2+依賴的CaMKKβ。另外還包括一個自抑制區(Auto-inhibitory domain)和一個與β-亞基和γ-亞基結合的區域。β-亞基包含兩個保守的區域——一個中間的糖原結合區和一個C-末端與其他兩個亞基的結合區。γ-亞基包含四個cystathionine-β-synthase串聯重複序列,組成兩個Bateman domains,每個Bateman domain能結合一個AMP或者ATP。
AMPK的激化
1)在低氧,缺血,熱激和營養缺乏的條件下,ATP的濃度水平降低。但是它通過高濃度的5'-AMP去平衡。5'-AMP和AMPK的γ亞基相互作用,激活AMPK。
2.1)LKB1(AMPK上游主要的激酶),假激酶STRAD和支架蛋白MO25的複合體,去磷酸化AMPK在蘇氨酸172α環位點,從而激活AMPK。
2.2)AMPK可能也直接通過CAMKK2作用在蘇氨酸172的α環而被激活。