簡介
 電流化學效應
電流化學效應電流通過導電的液體會使液體發生化學變化,產生新的物質。電流的這種效果叫做電流的化學效應。電的化學效應主要是電流中的帶電粒子(電子或離子)參與而使得物質發生了化學變化。化學變化中往往是這個物質得到了電子,那個物質失去了電子而產生了的變化。最典型的就是氧化還原反應。而電流的作用使得某些原來需要更加苛刻的條件才發生的反應發生了,並使某些反應過程可逆了(比如說電鍍、電極化)。
舉例
電解,電鍍,電離等就屬於電流的化學效應的例子。
碘化鉀溶液在通電後發生化學變化,碘能使澱粉變成藍色。
當 電流通過電解質時,在兩極會發生化學反應,這就是所謂 電流的 化學效應
水的組成與分解
組成:
氫氣燃燒可產生水
氫與氧組成水
分解:
接於電池兩極的金屬導線於水中生氣泡
水被 電流分解為氫與氧
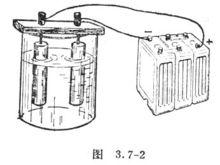
電解
利用電能,以引起分解的化學反應
裝置:
原理:正離子移向負極得電子而析出
負離子移向正極失電子而成中性原子析出
水的電解
注意事項:
針頭與銅線以絕緣膠帶纏緊是防氣泡從銅線冒出
純水極難電解故加入氫氧化鈉或硫酸鈉幫助導電.
試管內不能有空氣
裝置(一)
水的電解裝置(二)
水的電解觀察
負極產生的氣體與正極產生的氣體其高度比為2:1 體積比為2:1
兩極的極棒愈靠近,電解產生氣泡的速率愈快.
負極的氣體會使點燃的火柴產生爆鳴聲
氫之可燃性
正極的氣體會使帶火星的木條復燃
氧之助燃性
化合物與化學變化
水的電解討論
電解時,水中OH–離子移向正極,故正極可收集到氧氣;H+移向負極,故負極可收集到氫氣.
反應式:
負極:H++e- H2
正極:2OH– O2+2H++4e-
總反應:2H2O 2H2+O2
體積比: 2 : 1
質量比: 1 : 8
定比定律
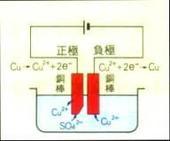
硫酸銅水溶液的電解
以碳棒做電極,因其穩定而不參與化學反應
硫酸銅於水中解離:2CuSO4→2Cu2++SO42–
銅離子移向負極得電子而析出紅色銅
碳棒質量增加,溶液中Cu2+減少,故藍色逐漸便淡
水比硫酸根離子易失電子,故正極是電解水的反應而生氧氣與H+ pH值降低
硫酸銅水溶液電解裝置
反應式:
負極:2Cu2++4e–→2Cu
正極:2H2O→4H++O2+4e–
總反應:
2Cu2++2H2O→2Cu+O2+4H+
這就是我們喝的水嗎
是否曾被賣淨水器的推銷員以家中的水來電解,而被電解水中出現黃色與綠色的各種污穢不堪的懸浮物所嚇到呢
事實上∶
其以鐵作正極而發生氧化反應,會產生有色的金屬離子或金屑錯離子: Fe→Fe2++2e-或Fe→Fe3++3e-
而電解水時負極產生鹼性物質,可與鋁電極生之鋁離子產生膠狀物質:2H2O+2e-→H2+2OH-
2Al+2OH-+6H2O→2A1(OH)4-+3H2
故有色污染物來自鐵棒,膠狀懸浮物來自鋁棒,
電鍍
電鍍∶利用電解反應,將一種金屬鍍於另一種金屬的表面,形成一層金屬外殼
原理∶利用電解反應,溶液中的金屬離子會在負極接受電子而析出
反應∶
正極:欲鍍金屬M M++e-
負極∶被鍍物表面做M++e- M
故用含M+之溶液作電鍍液
電鍍的圖解
電鍍實例一
鐵質鑰匙鍍上銅
正極:Cu→Cu2++2e–
負極:Cu2++2e–→Cu
全反應:
Cu(正極)→Cu(負極)
電鍍液:硫酸銅溶液
電鍍實例二
銅板鍍銀
正極:Ag→Ag2++2e
負極:Ag2++2e–→A
全反應:
Ag(正極) Ag(負極)
電鍍液:銀氰化鉀溶液
討論
溶液中金屬離子在負極獲得電子而析出,故負極重量增加,且受溫度, 電流強度及電鍍液濃度影響其薄膜的均勻堅實
正極金屬溶解成金屬離子進入電鍍液中,故正極重量減少
正極減少的質量等於負極增加的質量,故電鍍液的離子濃度不變.
用砂紙磨去銹斑,以氫氧化鈉水溶液洗去油污,因其造成導電不良
電鍍後,被鍍物體先以蒸餾水沖洗,再以丙酮洗淨,因丙酮為一種極易揮發的溶劑,故有助於加速乾燥硬化.
電鍍的功用,污染,處理
功用:
防止生鏽:能使電鍍層內的金屬與空氣,水分隔絕,以免生鏽.
增加美觀:能使物體表面光滑明亮.
提煉純金屬:粗銅中含金銀鋅等雜質,故將粗銅放於正極以電解出純銅於負極
 電流化學效應
電流化學效應磨光金屬表面:因正極金屬在通電過程中,都由突出部份先被電解融化,故可使金屬表面變光滑
電鍍的污染,處理
電鍍工業的廢棄物可能含有銅,鉻,鋅等重金屬,濃度高時都有毒性.對環境造成很嚴重污染.
鍍銀的電鍍液中含有劇毒的氰化物(含CN–),必須加以處理才能排放.
民國75年4月間的二仁溪河口綠牡蠣事件,就是二仁溪上游電鍍業者隨意排放電鍍廢棄液的結果,造成銅離子的污染.通常可在銅離子水溶液中加入鋼絲絨,使其反應,析出金屬銅.
化合物與化學變化
化學變化:原分子發生改變產生新分子,性質也改變了
化合物:由兩種或兩種以上的元素以一定的比例組成的新物質
與其成分元素的性質完全不同
必須用化學變化來分解出他的成分
是一種純物質,具有一定熔點與沸點.
水電解後產生氫和氧.其三種性質完全不同,故水的電解是一種化學變化.
定比定律
定比定律:組成化合物的各種元素之間,其質量比恆為一定值.
Ex:H2O含H,O質量比為1:8;CO2含CO質量比為3:8
故不論用何種方法得知化合物,其成分元素質量比恆保持定值
Ex:氫氣燃燒與雙氧水分解來的水其H,O質量比皆為1:8