合成舉例
以六價為例
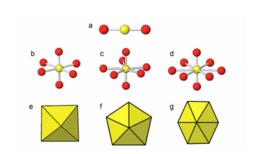
化合物I—V的鈾絡合物的合成及鑑定。這些化合物的結構為:
 鈾絡合物
鈾絡合物Ⅰ:Z=CHOCHn=1
Ⅱ-V:Z=CHn=0-3
在製備上述化合物與鈾酞離子的絡合物時發現,其絡合作用比較迅速,將它們混合後,很快就產生絡合物的沉澱。合成操作如下:
以10~15毫升乙酸乙醋分別溶解0.1毫摩爾化合物I-V,再以0.5-1毫升甲醇溶解約0.08毫摩爾硝酸鈾,混合二溶液後,很快產生黃色沉澱,加熱回流30分鐘,冷卻過濾,洗滌乾燥後即得產物。
所得到的鈾絡合物,都測不到熔點,加熱溫度達200℃後逐漸分解。對所得絡合物進行外光譜(石蠟油法分析,其主要吸收峰位置為:1600~1620、1550~1560、1500、1280~1290、920~935、770及700cm 。與化合物(I~V)的紅外光譜相比,除了有醚鍵、芳環等吸收外,圖譜有很大改變,特別是原來這些化合物1665~1670cm 處的羰基吸收峰消失,移至1610cm 左右,這與羰基與金屬離子絡合後羰基吸收峰向低波數移動的規律是一致的。鈾酞離子的存在可由925cm 左右的吸收峰得到證實(UO 的反對稱伸縮振動吸收)。同時,還可觀察到1500cm 附近硝酸根的吸收峰。對所得絡合物進行元素分析證明其簡單絡合比為1:1(數據見表1)。
以上初步工作,證明所得化合物(I-V)與鈾醯離子的絡合能力,為尋找開鏈王冠類似物的新型末端基提供了依據。
| 化合物 | 金屬離子 | 絡合物簡單組成 | 絡合比 | 收率(%) | 元素分析(%) | |||
| U | C | H | N | |||||
| Ⅰ | UO | [Ⅰ·UO](NO) | 1:1 | 85 | ①27.25 | 35.75 | 3.48 | 9.75 |
| ②27.28 | 35.79 | 3.47 | 9.63 | |||||
| Ⅱ | UO | [Ⅱ·UO](NO) | 1:1 | 83 | ①28.58 | 34.57 | 3.25 | 10.03 |
| ②28.73 | 34.79 | 3.16 | 10.14 | |||||
| Ⅲ | UO | [Ⅲ·UO](NO) | 1:1 | 91 | ①28.17 | 35.16 | 3.30 | 9.92 |
| ②28.25 | 35.64 | 3.35 | 9.97 | |||||
| Ⅳ | UO | [Ⅳ·UO](NO) | 1:1 | 92 | ①27.91 | 36.20 | 3.51 | 9.89 |
| ②27.79 | 36.46 | 3.53 | 9.81 | |||||
| Ⅴ | UO | [Ⅴ·UO](NO) | 1:1 | 89 | ①26.91 | 37.59 | 3.74 | 9.52 |
| ②27.34 | 37.25 | 3.71 | 9.65 | |||||
| 註:①測定值;②計算值 | ||||||||
主要配合劑
就鈾化學說來,鈾與碳酸氫根生成的配合物對於生理學來說是很重要的。Dounce等人(1949)證明相當難溶於水的鈾化合物在有CO通過的血清中具有有限的溶度速率。這可歸因於鈾與存在的碳酸氫根離子生成配離子。
鈾醯離子也可以與蛋白質配合,鈾一旦進入血液,它很快在鈾-碳酸氫鹽和鈾-蛋白質兩種配合物之間建立平衡。Chevari和Likhner(1968)測定了六價鈾離子與碳酸氫鹽、血漿白蛋白以及紅細胞膜脂蛋白的穩定常數(見表2)。鈾(Ⅳ)與碳酸氫鹽生成的配合物不如鈾(Ⅵ)與碳酸氫鹽生成的配合物穩定,鈾(Ⅳ)和鈾(Ⅵ)都可以使蛋白質沉澱,在pH值小於7時沉澱最好,而在pH值較高時,會生成配合物。
| 配合物 | n | logβ |
| 碳酸氫鹽 | 1.7 | 18.04 |
| 血漿白蛋白 | 0.6 | 10.48 |
| 紅細胞膜脂蛋白 | 0.46 | 8.90 |
鈾醯配合物
鈾最穩定的價態是正六價,其配合物多為8配位,超過8的配位數比較少見。在含鈾晶體配合物中,鈾大多數是以鈾醯離子,(UO )的形式存在的,鈾醯離子可以與多種原子配位,如O, N,S,Cl,I等。鈾醯離子中兩個配位位置被UO 中的氧占據,因此UO 中有六個空位可以與配體進行配合。
5f-6d軌道的雜化導致UO 為直線型,垂直於UO 直線的赤道平面上通常連線4,5或6個配位,形成了四角、五角、六角雙錐的構型。如圖所示。
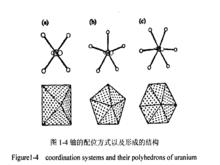 鈾的配位方式以及形成的結構
鈾的配位方式以及形成的結構在鈾醯化合物中,大多數兩端的氧原子與鈾原子在一條直線,這樣的空間位置致使赤道位置上的配位原子都處於同一平面上,有時因為配體的配位空間結構的原因導致個別原子偏離平面方向。此外,赤道平面內的氧易於橋連到其他的原子上,形成配位聚合物。
報導過通過在鈾醯離子上的氧原子配位並且向外延伸形成配位化合物的文獻很少見,現今能夠合成出來的以鈾醯離子為中心的配合物絕大多數是以鈾醯離子的O-U-O為軸向,其他配體處在赤道位置的雙錐結構的配合物,通過鈾醯離子上的端基氧配位形成3D的鈾醯配合物化學仍然有很廣泛的發展空間,有待以後的化學工作者進一步研究。
研究與套用
光度法測鈾
有機顯色劑PAR(4-2-吡啶偶氮-間苯二酚)用於光度法測鈾,檢測限1ppm。研究發現UO -PAR絡合物在溶液pH=8.8~9.8時,於試劑波之後產生清晰的吸附波。在儀器最小倍率下無空白訊號。峰電流(i)與鈾濃度在0.08~2.40μg/ml間呈線性關係、引入氟離子和二苯胍時i增加、波形改善(與試劑峰分離更遠)。本體系對與鈾常伴生的釷、稀土元素有較好的抗干擾性。採用BTP反相色層法容易分離鐵、銅、鈷、鎳、釩、鉻和鈦等嚴重干擾的元素,使本法具備良好的適用性。對於含鈾0.0005%以上的礦石分析,相對標準偏差小於±10%。
修復鈾污染土壤
1)pH值、總碳酸根和鈣離子濃度的增加會抑制紅土吸附鈾。pH值為7.0,紅土投加量為1g/L,鈣離子、總碳酸根和初始鈾的濃度分別為0.4mmol/L、3.8mmol/L和50mg/L時,紅土對鈾的最大吸附容量約4.20mg/g。鈾在紅土上的吸附形態為UO(CO) 、UO(CO) 和UO(CO)(AQ),鈣-鈾-絡合物的形成會抑制紅土對鈾的吸附。
2)紅土孔隙水的pH值接近中性或鹼性時,利用c(U-CO)可預測紅土對鈾的理論吸附容量。鈾吸附容量的擬合方程為q=18.2(c(UO )c(CO )(K+Kc(CO )+Kc c(CO ))) ,根據c(U-CO)和q的非線性關係,進而證實鈾-碳酸絡合物總量決定了鈾的吸附容量。
對小分子氣體的活化
利用元素鈾豐富的成鍵軌道以及多種氧化態的特性,通過對有機配體位阻和電子效應的微妙修飾,獲取了多種具有催化活化性質的三價鈾有機絡合物,該類化合物對NCO和CO都可進行活化反應。
鈾中毒的防治
鈾(VI)在體內沉積的主要部位是骨骼和腎臟,鈾(IV)除在骨骼和腎臟外也在肝和脾臟積累。鈾對活細胞的毒性在於阻礙碳水化合物的新陳代謝,尤其是阻礙酶體系的新陳代謝。鈾醯離子可以與多種配合劑形成穩定的配合物,因此可以利用這一性質採用適合的配合劑清除人體內的鈾。選用配合劑時不僅要考慮配合配體與鈾離子的親和力,還要考慮配合配體與人體內其他金屬離子的親和力,如血清里的鈣可以與配合配體強烈反應。生成的配合物應該具有以下性質:水溶性與擴散性、低毒性、不與體內正常組分反應、口服時具有高度吸附作用、以及不被代謝的性質。
lvannikov等人報導:硫醚,二氨基二乙基硫醚四乙酸除去大白鼠有機體中的鈾以及降低鈾在器官組織中的積累量比EDTA有更大的生物效應。