基本觀點
 過渡狀態理論
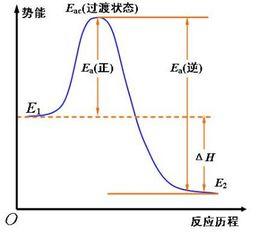
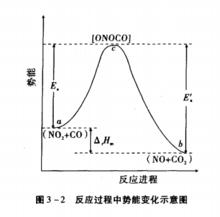
過渡狀態理論過渡狀態理論認為,化學反應不只是通過反應物分子之間簡單碰撞就能完成的,而是在碰撞後先要經過一個中間的過渡狀態,即首先形成一個活性基團(活化配合物),然後再分解為產物。活化配合物中的價鍵結構處於原有化學鍵被削弱、新化學鍵正在形成的一種過渡狀態 ,其勢能較高,極不穩定,因此活化配合物一經形成就極易分解。在反應歷程中反應物分子必須越過勢能壘才能經由活化配合物生成產物。兩個分子碰撞前的能量越大,碰撞就越劇烈,分子可以在碰撞中獲得足夠的勢能,從而改組反應物分子的化學鍵。在碰撞中獲得足夠能量的反應物分子 ,會形成一種過渡狀態,稱為活化體,亦稱活化絡合物。處於此種狀態時舊的化學鍵己經削弱,新的化學鍵己經形成。活化體的壽命很短,一經生成,就很快向產物分子轉化。全過程為:A+BC吸收能量形成A ..B..C ,放出能量生成AB+C。過渡狀態理論認為正逆反應在進行過程中,都必須經過同一活化體這樣一個過渡狀態。過渡狀態理論吸取了碰撞理論的合理部分,把活化能的概念提高到化學鍵的角度來理解。認為不同的物質分子化學鍵的鍵能不同,使得各種化學反應過程中改組化學鍵所需的能量不同 ,因而不同的化學反應具有不同的活化能,這是化學反應速度不同的內在因素。
觀點辨析
近十幾年來國內各種版本的《無機化學》和《普通化學》教材中,關於化學反應速度的過渡態理論的闡述中,有些提法筆者認為在教學過程中往往會引起學生的困惑。多數的教材都認為活化絡合物的壽命很短,一經生成就很快向產物分子轉化。正因為如此 ,多年來經過許多科學家的努力都沒有能夠將活化體從體系屮分離提取出來。並且都認為反應的速度取決於改組分子結構所需的能量,即取決於活化能。
但是,有個別的教材卻提出這樣的觀點:對於A+BC反應生成AB+C這樣的反應,其過程中必須經過勢能很高的A..B..C,並認為 A+BC生成A..B..C較快,A..B..C生成AB+C較慢。其間敘述認為活化絡合物不穩定,可分解 得到AB和C,亦可分解得到A和 BC。認為 ,反應物質通過過渡狀態的速度 ,即活化絡合物分解為產物的速度就是該化學反應的速度。
筆者認為上述有些提法是與一般教材不一致的,而且也是自相矛盾的。例如認為活化體是不穩定的,又認為A..B..C生成AB+C分解速度是較慢的;又如認為活化體分解為產物的速度即是化學反應的速度,這種觀點似乎與化學反應的速度取決於反應中改組反應物分子結構所需的能量,即取決於活化能的觀點不太一致。所以在教學過程屮往往引起學生理解上的困惑。本來化學反應速度的過渡態理論是一個正在探討的理論,什麼樣的提法都不能定可否,但是將一些不成熟的論點引入教材,這是造成學生理解上困惑的主要原因。
相關概念
活化能
反應物分子的平均勢能與活化配合物的勢能之差為正反應的活化能, 生成物分子的平均勢能與活化配合物的勢能之差為逆反應的活化能。在過渡狀態理論中,活化能的實質為反應進行所必須克服的勢能壘。由此可見,過渡狀態理論中活化能的定義與分子碰撞理論不同,但其含義實質上是一致的。
過渡態
過渡態是基元反應反應坐標中能量最高的一點所對應的分子構型。處於過渡態的分子也稱為活化絡合物。理論上,活化絡合物是極不穩定的,它向反應物和產物轉化的機率相等;
1、絕對的不可逆反應中,在過渡態這一時刻,所有的碰撞分子都會轉化為產物。
2、根據量子力學理論,活化絡合物布居為零,過渡態是能量最高的一點,任何擾動都會導致它的改變,故無法分離出來,也是無法觀測到的。
意義
 過渡狀態理論
過渡狀態理論過渡狀態理論為認識化學反應奠定了理論基礎。在過去的幾十年里, 化學家們一直 在通過各種方法試圖直接觀察到過渡態,以求對化學反應有一個全面深人的理解。20世 紀 50年代,科學家們用快速動力學方法,可分辨出千分之一秒(ms) 的化學中間體。60年 代 ,又採用了分子朿技術來探討分子碰撞的動態過程,實現了單個分子碰撞過程的研究, 但仍只是停留在對成分進行分析的水平上。70年代末,將雷射技術和分子束技術相結合 用於研究化學反應的過程。80年代中期,將超短雷射脈衝和分子束技術相結合製成了分 子“照相機”,其解析度可達6 fS(飛 秒 ),大大小於分子的振動周期,使得跟蹤化學反應 的過程成為了現實。人們終於可以直接觀察到過渡態,並以此為基礎,形成了一門新的學 科——飛秒化學。它是以飛秒為時標來研究化學反應的過程,對研究化學鍵的斷裂和形 成是非常有用的。例如,分子中有兩個相同的C一I 鍵 ,但在進行化學反應的過程中,C一I 鍵的斷裂卻是分步進行的,通過飛秒化學對化學反應的探究可以得到證實。研究表明,第一個C-I鍵在不到0.5 ps(皮秒)時間內斷裂,而第二個C-I鍵則需要50 ps以上的時間才能斷裂。由此可見,飛秒化學的產生和發展是人們真正從微觀層次上研究化學的過程,更新、深化和豐富了人們對化學反應過程的認識,從而達到有效地控制化學反應,並能通過雷射對分子進行選鍵分解(即分子剪裁)。
與碰撞理論比較
碰撞理論是套用經典力學研究基元反應的化學動力學反應速率的理論。
其理論要點(假設)可歸結為:(1)反應物分子是硬球;(2)反應發生必須進行碰撞;(3)碰撞分子對的相對平動能在聯心線方向上的分量超過臨界值Ec的是有效碰撞;(4)體系的能量分布遵守麥克斯韋-玻爾茲曼分布律。
但是該理論未考慮分子的複雜性,理論計算與實驗結果有時差別較大,進一步的修正是考慮碰撞分子的相互取向和方位,用空間因子聲來修正。該理論首先是由W.C.M.路易斯提出,並為許多學者充實和發展,理論上對指前因子以定量的解釋,對於活化能基本上保持了阿累尼烏斯公式固有的概念。方位因子也由實驗確定,但所建立的化學反應的模型開始擺脫以阿累尼烏斯公式作為經驗事實接受的狀況,是有其歷史功績的。