 逆凝結:壓力減小發而變為液體,及液相增加,與正常凝結剛好相反.
逆凝結:壓力減小發而變為液體,及液相增加,與正常凝結剛好相反.以凝析氣藏的形成為例說明:
烴類純物質的相態:在溫度一定時,隨壓力增加,體積縮小,到達露點A後,壓力不變而體積繼續縮小,直到泡點B後,壓力增大體積變化甚微,露點A為開始液化的點,泡點B為完全液化的點,A-B為氣液兩相共存區段,其對應的壓力為飽和蒸汽壓,大小取決與溫度,溫度升高,A-B線段逐漸縮小,直到臨界點K。
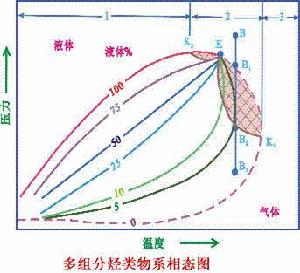
多組分烴類相態及凝析氣藏的形成:多組分烴類物系相態圖與烴類純物質的相態圖不同,其露點線和泡點線交繪於臨界點K,所圍區域為氣液兩相共存區,臨界凝析壓力點K2和臨界凝析溫度點K1之間為逆凝析區,在該區內,低壓條件下(B3)為氣態,壓力增大到(B2)後,壓力增大液相反而減小,到B1點則完全氣化,這與正常蒸發概念完全相反,稱為逆蒸發,相反的過程稱為逆凝結,凝析氣(油)藏的形成正是逆蒸發(逆凝結)相態轉變的結果。
臨界凝析溫度點K1:多組分相態中,不管壓力多大,梵谷於此溫度便不能形成液體。
臨界凝析壓力點K2:多組分相態中,不管溫度高低,梵谷於此壓力便不能形成氣體。
