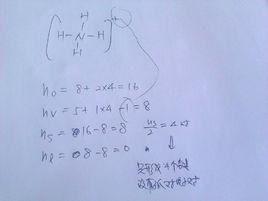學說介紹
1916年美國化學家G.N.Lewis提出了共價學說,建立了經典的共價鍵理論,此理論的核心是原子間通過共用電子對形成最外層8電子的穩定結構(ns2np6)(氫除外)。故路易斯價健理論又稱八隅體理論。
A、B 兩原子各有一個成單電子,當 A、B 相互接近時,兩電子以自旋相反的方式結成電子對,即兩個電子所在的原子軌道能相互重疊,則體系能量降低,形成化學鍵,亦即一對電子則形成一個共價鍵。
形成的共價鍵越多,則體系能量越低,形成的分子越穩定。因此,各原子中的未成對電子儘可能多地形成共價鍵。
配位鍵形成條件:一種原子中有孤對電子,而另一原子中有可與孤對電子所在軌道相互重疊的空軌道。在配位化合物中,經常見到配位鍵。
該理論適用於絕大多數主族元素的共價化合物和含共價鍵的離子,而路易斯結構式的表示要求是:用短線表示原子間形成的共價鍵,同時用小黑點表示未用於形成共價鍵的電子(非鍵合電子),也可省去這些小黑點。這裡應注意:非鍵合電子可以是成對的(孤對電子),也可以是成單的(自由基中)。
具體書寫規則
求出分子結構中成鍵數和孤電子對數
成鍵數=按稀有氣體結構計算的各原子最外層電子數之和—各原子價電子數之和/2孤對電子對數=各原子價電子數之和—成鍵電子總數/2
例 HNO 成鍵數=[(2+8+8×3)-(1+5+6×3)]/2=5
孤對電子對數=[(1+5+6×3)-(5×2)]/2=7
排出正確的原子連線
H原子只有一個電子,在通常的共價分子中它只能形成一個,故在分子結構中它一般排列在外;F原子具有最大的電負性,價電子中只有一個成單電子,又無可以利用的d軌道,所以它也只能形成一個,在分子結構中排列在終端。
電負性較小的原子,由於其價電子被原子束縛的力較小,而易與其他原子所共用,所以在它周圍排列的原子數一般比電負性較大元素原子周圍的原子數多,故電負性較小的原子常處於分子中心,電負性較大的原子一般排列在分子的終端。
路易斯結構式的書寫
根據求出的成鍵數、孤對電子對數和原子間連線規則,寫出可能的路易斯結構式。
(1)原子間以短線相連,短線總數達到成鍵數。
(2)孤電子對用一對對小黑點從端基原子標起,依次到各原子,使每個原子都達到稀有氣體原子的穩定結構(8電子或2電子)直到孤對電子全部標完。
結構式穩定性比較
若某物質的路易斯結構式能寫出多種,應比較各自的穩定性,排除不穩定的結構,而形式電荷是分子路易斯結構式穩定性比較的依據。
(1)某原子的形式電荷=該原子的價電子數減去結構中該原子最外層電子數(成鍵電子平均分給兩成鍵原子)。
(2)若物質路易斯結構式中各元素原子的形式電荷為零,這種結構是最穩定的;若相鄰兩原子的形式電荷是同號,這種結構不穩定,可不予考慮。
(3)若某分子比較穩定的結構有幾種,這幾種結構就互為共振關係。
(4)注意以下幾點:
a.形式電荷只表示原子積累電荷的相對多少,並不是說明該化合物就是離子化合物,也不是由電負性決定的,與元素性質無關,僅僅是表觀電荷。
b.當然,正負電荷(形式電荷)分別分布在電負性較小和較大的原子上的結構優先確定;
c.形式電荷數值較低的結構優先確定。
最後說明一下,當中心原子是S、P、Cl等“富”電子原子時,該原子周圍可以多於四對電子。有一種說法是將其原子周圍視作四對電子時的結構中部分孤電子對變成鍵合電子,以降低中心原子的形式電荷,成為穩定結構。